Tutustu viimeaikaisiin artikkeleihin
Abstrakti
Low-output heart failure (LoHF) on harvinainen sydämen vajaatoiminnan muoto, mutta se on merkki hyvin kehittyneestä sydämen vajaatoiminnasta. Siihen liittyy pahaenteinen ennuste sekä huomattava sairastuvuus ja kuolleisuus. LoHF on kuitenkin edelleen pitkälti alitutkimuksissa. HF: n perinteisessä kuvauksessa keskityttiin kongestiiviseen sydämen vajaatoimintaan (CHF), jota leimaa sydämen alhainen teho ja johon liittyy keuhkojen/perifeeristen alueiden tukkoisuus. Keskittyminen vähensi osaltaan LoHF-potilaiden arvostusta, sillä heillä on vain vähän tai ei lainkaan näyttöä ruuhkautumisesta. LoHF-potilailla ei myöskään ole todistettua hoitoa, ja sopivan hoidon valinta riippuu yksilöllisestä patofysiologiasta ja taustalla olevasta etiologiasta. LoHF-potilailla on heterogeeninen etiologia ja patofysiologia, mikä korostaa sen kliinisten ominaisuuksien, diagnoosin ja kliinisen hoidon syvällisen ymmärtämisen tärkeyttä, mikä muodostaa tämän katsauksen perustan.
avainsanat
low-output-sydänoireyhtymä, low-output-sydämen vajaatoiminta, low-output-tila
Johdanto
huolimatta merkittävästä kehityksestä lääketieteellisissä ja kirurgisissa hoidoissa sydämen vajaatoiminnan tehokas hoito aiheuttaa edelleen merkittäviä haasteita terveydenhuollon tarjoajille. Haastetta kuvastaa se, että HF-sairaaloiden takaisinottojen määrä on suuri sekä kuolleisuus ja sairastuvuus lisääntynyt . Osa haastetta on hyvin heterogeeninen aetiologia, patofysiologia ja HF: n eri muotojen kliiniset esitykset, joissa joillakin HF: n muodoilla on vähän kliinistä tutkimustietoa ja siten rajallinen ymmärrys. Erityisesti HF: n perinteinen kuvaus on ollut lähes synonyymi kongestiiviselle sydämen vajaatoiminnalle, mutta termi CHF sulkee pois vähemmistön niistä HF-potilaista, joilla on vain vähän tai ei lainkaan osoitettavissa olevia keuhko-ja/tai perifeerisen tukkoisuuden oireita . Low-output HF (LoHF) on myös liitetty pahaenteinen ennuste ja signaalit hyvin kehittynyt HF. Lisäksi OIREENMUKAISET ja patofysiologiset erot CHF: ssä ja LoHF: ssä tukevat erilaisten kliinisten hoitomenetelmien tarvetta . Näistä eroista huolimatta perinteiset HF-hoidot on yleistetty kaikkiin HF: n muotoihin, mukaan lukien CHF ja LoHF, mikä luo kliinisen tarpeen ymmärtää LoHF: n patofysiologiaa, diagnoosia ja kliinistä hoitoa. Tässä artikkelissa yhdistämme julkaistuja todisteita LoHF: stä epidemiologian, etiologian, patofysiologian, diagnoosin ja kliinisen hallinnan osalta. Tarkoituksena on lisätä tietoa LoHF: n kliinisestä asemasta sekä parantaa HF: n kliinistä hoitoa yleensä.
määritelmä
sydämen vajaatoiminta on monimutkainen kliininen oireyhtymä, jolle on ominaista rakenteelliset ja / tai toiminnalliset sydänlihasvauriot, jotka johtavat heikentyneeseen kammion täyttymiseen tai ejektioon . Oireyhtymän monimutkaisuus käy ilmi sen heterogeenisistä luokituksista: Oikea -, Vasen-tai bi-kammio, joka perustuu vian sijaintiin; akuutti tai krooninen, joka perustuu alkamisaikaan; säilynyt, rajatapaus tai pienentynyt ejektiofraktio, joka perustuu toiminnalliseen tilaan; matala-tai korkea-lähtö perustuu sydämen lähtö (CO), ja eteen-tai taaksepäin vika perustuu suuntaan verenkiertoa. Jokainen näistä luokituksista on merkittävä HF: n diagnosoinnissa ja hoidossa . Useista luokitteluista huolimatta termiä CHF on perinteisesti käytetty vaihdellen HF: n kanssa, mutta se ei kuvaa riittävästi LoHF: ää useiden oireellisten ja patofysiologisten erojen vuoksi.
LoHF, joka tunnetaan myös nimellä matala CO akuutissa dekompensoidussa HF: ssä, kuvaa HF: n korkean tarkkuuden muotoa, jolle on ominaista alentunut eteenpäin (sydänindeksi < 2.0 L/min/m2 ja systolinen verenpaine < 90 mmHg) ja loppuelimen hypoperfuusio, johon liittyy vain vähän tai ei lainkaan merkkejä keuhkojen tukkoisuudesta . LoHF eroaa CHF: stä, joka kuvaa HF: ää, jolle on ominaista keuhkoverenkierron väheneminen ja perifeerinen tukkoisuus, joka johtaa dyspneaan ja perifeeriseen turvotukseen . 2005 European Society of Cardiology (ESC) guidelines on diagnosis and management of HF ehdottaa jatkumo low cardiac output syndrome (LCOS) LoHF ja cardiogenic shock. ESC-ohjeissa kardiogeeninen sokki määritellään todisteeksi HF: n aiheuttamasta kudosperfuusiosta sen jälkeen, kun systolinen verenpaine < 90 mmHg tai valtimopaineen lasku > 30 mmHg; virtsaneritys < 0, 5 ml/kg/h; pulssi > 60 lyöntiä minuutissa (BPM) ruuhkautumisen kanssa tai ilman . LCOS on toisaalta yleinen post-operatiivinen HF potilaat ja määritellään tarve post-operatiivinen intra-aortan ilmapallo pumppu tai inotrooppinen tukea yli 30 minuuttia akuutissa hoito ympäristössä .
epidemiologia
LoHF: n tarkka esiintyvyys ja esiintyvyys yleisväestössä on täysin tuntematon. Tällä hetkellä lohf: lle ei ole väestöpohjaista epidemiologista tietoa. Ainoat saatavilla olevat tiedot ovat yhden keskuksen kliinisistä tutkimuksista, joissa tutkittiin valikoitua sydänleikkauksen läpikäyneiden HF-potilaiden ryhmää. Vuonna 1975 Parr ym. teki siemennesteen kuvauksen LCOS: n kliinisestä kokonaisuudesta ja raportoi 25%: n esiintyvyyden lapsilla, joille oli tehty sydänleikkaus perustuen alentuneeseen CO-arvoon (CI < 2, 0 L/min/m2). Kaksi vuosikymmentä myöhemmin, Wernovsky et al. osoitti saman leikkauksen jälkeisen LCOS: n esiintyvyyden potilailla, joille oli tehty valtimonvaihtoleikkaus 6-18 tunnin kuluessa leikkauksesta. Monissa viimeaikaisissa kliinisissä tutkimuksissa on havaittu suurta vaihtelua esiintyvyydessä: 3, 6%: sta (miehet) ja 5, 9%: sta (naiset) 9, 1%: iin ja 41%: iin ja esiintyvyys 14, 7%: iin . Viime pitkällä aikavälillä (kaksikymmentä vuotta: 1990-2009) prospektiivinen kliininen tutkimus, johon osallistui 25 176 peräkkäistä sepelvaltimon ohitusleikkauspotilasta (CABG), Algarni ym. raportoitu postoperatiivisten LCO: iden esiintyvyys väheni merkittävästi 9, 1%: sta (1990-1994) 2, 4%: iin (2005-2009) .
etiologia
LoHF: n etiologia on monitekijäinen. Yleensä se on seurausta vasemman kammion (LV), oikean kammion (RV) tai systeeminen kammion (yhden kammion anatomia) toimintahäiriö ja voi sisältää joko tai sekä systolinen ja/tai diastolinen toimintahäiriö . Häiriöt kammion täyttö tai ejektio johtaa LoHF, joka on usein komplikaatio potilailla, joille on tehty sydänleikkaus tai ovat kardiogeeninen sokki . Se voi ilmetä akuuttina huononemisena kroonista munuaisten vajaatoimintaa sairastavilla potilailla tai se voi olla ohimenevä ja palautuva episodi, jolloin akuutti laukaiseva tekijä häviää. Se on kliininen oireyhtymä, jota pidetään useiden sydämen toimintaan vaikuttavien sairauksien lopullisena kulkureittinä. Se ei riitä tekemään diagnoosi LoHF, perimmäinen syy tai laukaista on myös määritettävä, ja jos mahdollista, käsitelty . Taulukossa 1 esitetään yhteenveto tiloista, jotka aiheuttavat HF-potilailla alhaisen tuotoksen.
Taulukko 1. Alhaisen tuotoksen tilan etiologia patofysiologian mukaan
|
mekanismit |
|
|
sydänlihaksen supistuvuuden menetys |
sepelvaltimotauti, kardiomyopatia, sydänlihastulehdus, dekompensoitu krooninen HF, sydämen leikkauksen jälkeinen hoito, toksiinit, ravitsemus (lihavuus)m infiltratiiviset sairaudet, loppuvaiheen munuaisten vajaatoiminta, Chagasin tauti tai HIV-infektio |
|
heikentynyt kammion täyttö tai ejektio |
perikardiitti, perikardiaalinen effuusio, sydäntamponaatio, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
nykyinen käsitys LoHF: n patofysiologiasta perustuu suurelta osin leikkauksen jälkeisillä OHITUSLEIKKAUSPOTILAILLA tehdyistä kliinisistä tutkimuksista saatuun näyttöön . Patologisena tunnusmerkkinä on liiallinen depressio, johon liittyy end-elin hypoperfuusio. Fysiologisesti sydän toimii pumppuna, joka jakaa hapetettua verta riittävästi kudosten aineenvaihdunnallisten tarpeiden tyydyttämiseksi. Koska aineenvaihdunnan tarpeet vaihtelevat normaaleissa ja stressaavissa tilanteissa, CO vaihtelee myös tämän dynaamisen kysynnän tyydyttämiseksi . Sydänkierron diastolinen vaihe on kriittinen LoHF-potilailla, koska juuri kammion relaksaation aikana sepelvaltimoiden täyttäminen tapahtuu tarjoamaan sydänlihaksen hapetusta . Syke (HR) on merkittävä myös diastolissa, koska liian nopea HR estää sydäntä saavuttamasta täydellistä sydänlihaksen rentoutumista ja perfuusiota. Sydämen toimintahäiriö johtuu siis rakenteellisesta (sydämen jäännöspoikkeamasta) tai toiminnallisesta sydämen häiriöstä (kammioiden täyttymisen tai tyhjenemisen häiriöt tai lisääntynyt systeeminen verisuonivastus).
Patofysiologisesti CO riippuu HR: stä ja iskutilavuudesta (SV) (CO = HR * SV). Iskutilavuus puolestaan on kolmen toisiinsa liittyvän kiertomuuttujan nettotuote: esijännitys, jälkikuormitus ja supistuvuus. Jos yksi tai useampi näistä komponenteista on heikentynyt, voi kehittyä matala sydämen lähtötila . Lisäksi nämä komponentit vaikuttavat sekä systoliseen että diastoliseen sydänkierron vaiheeseen aiheuttaen LV/RV-systolisen toimintahäiriön ja / tai diastolisen toimintahäiriön, joka tunnetaan myös nimellä HF ja jossa on säilynyt ejektiofraktio (Kuva 1). Muut ehdot, kuten läppävika, keuhkoverenpainetauti (pH), mekaaninen venttiilin toimintahäiriö ja hengitysvajaus voivat sysätä tai pahentaa lohf: n kehittymistä .
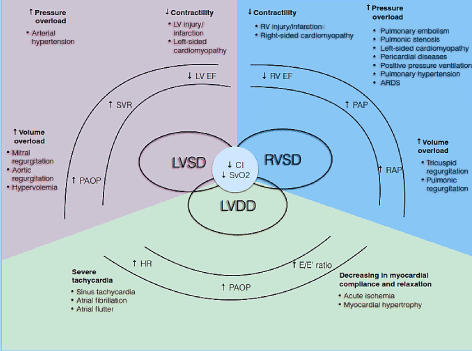
kuva 1. Matalatehoisen sydämen vajaatoiminnan patofysiologiset mekanismit
yleiset syyt ja tyypilliset; LoHF: n oireet ovat mukana. Lohf: n tärkeimmät patofysiologiset mekanismit ovat kammion toimintahäiriö: LV systolinen ja / tai diastolinen toimintahäiriö ja RV systolinen toimintahäiriö, joilla kaikilla on yhteisiä patologisia piirteitä: alentunut sydänindeksi (CI) ja alentunut laskimoiden happisaturaatio (SvO2). LV: n ja RV: n systolinen toimintahäiriö johtuu lisääntyneestä paineen ylikuormituksesta, lisääntyneestä tilavuuden ylikuormituksesta ja supistumiskyvyn heikkenemisestä, kun taas LV: n diastolinen toimintahäiriö johtuu vakavasta takykardiasta ja sydänlihaksen sitoutumisen ja rentoutumisen vähenemisestä. Mukautettu lomivorotov et al. 2017, s.
LV ystolinen toimintahäiriö
vasemman kammion (LV) systolinen toimintahäiriö (tai LV: n ejektiofraktio ) on yleisin lohf-potilailla havaittu patofysiologinen mekanismi. LV: n systoliseen toimintaan vaikuttavia kiertomuuttujia ovat esijännitys, kuormituksen jälkeinen kuormitus ja supistuvuus . Yleensä LV systolinen toimintahäiriö on seurausta toiminnallisten kardiomyosyyttien menetyksestä tai vähenemisestä johtuen sepelvaltimon verenkierron heikentymisestä ja iskemiasta, reperfuusiovauriosta tai kardiomyosyyttien apoptoosin vähemmän ymmärretystä luonnollisesta ilmiöstä . Funktionaalisten kardiomyosyyttien menetys voi olla ohimenevää, mikä näkyy sydänlihastainnutuksen aikana määriteltynä elinkelpoisena sydänlihaksena, joka pelastetaan sepelvaltimoiden reperfuusiolla, jossa ilmenee pitkittynyt reperfuusion jälkeinen iskeemisen toimintahäiriö . Menetys toiminnallinen kardiomyosyytti voi myös olla tulenkestävä kääntyminen olosuhteissa, kuten infektio; takykardia; läppävika; aineenvaihdunnan häiriöt, kuten asidoosi, hypoglykemia, hypokalsemia; altistuminen ympäristön sydänmyrkkyjä ja kemikaaleja; idiopaattinen laajentuneen kardiomyopatia (DCM); ja geneettiset häiriöt, kuten familiaalinen DCM, hypertrofinen kardiomyopatia ja lihasdystrofiat . Heikentynyt sydänvaste esikuormitukselle aiheuttaa dramaattisen Co-ja hapensaannin vähenemisen muihin keskeisiin kehon elimiin, kohonneen eteispaineen, kapillaarikiilapaineen ja kardiogeenisen keuhkoödeeman. Vaikka LV: n kompensoivat muutokset sopeutuvat suhteellisen korkeaan systeemiseen valtimopaineeseen, merkittävä jälkikuormituksen kasvu voi aiheuttaa LV: n systolisen toimintahäiriön .
LV: n diastolinen toimintahäiriö
vaikka lohf on melko harvinainen, se voi kehittyä potilaille, joilla on LV: n diastolinen toimintahäiriö ja säilynyt LVEF. Tila johtuu kammion kyvyttömyydestä täyttää riittävä määrä verta normaalista esijännityksestä huolimatta, mikä ilmenee diastolisena toimintahäiriönä . Perussairaudet, kuten vaikea takykardia, heikentynyt sydänlihaksen noudattaminen tai epänormaali kammion relaksaatio, heikentävät LV: n relaksaatiota ja täyttymistä sydänkierron diastolivaiheen aikana. Kardiomyosyyttitasolla nämä olosuhteet liittyvät kalsiumin poistoon sytosolista ja kalsiumin homeostaasista, sillan irtoamisen riittävyyteen ja luontaiseen toiminnalliseen sytoskeletaaliseen elementtihäiriöön . Sillan irtoaminen voi edistää viivästynyttä isovolumista rentoutumisaikaa, mikä vähentää LV-iskun määrää erityisesti korkeammalla HR: llä . LV: n relaksaatio riippuu myös sarkoplasmaisen retikulaarisen kalsiumionin takaisinotosta ja typpioksidin signaloinnista, jotka myös helpottavat siltojen välistä irtoamista. Koska sillan irtoamisprosessi kuluttaa energiaa, se voi aiheuttaa sydänlihaksen energian vajauksen ja siten hidastaa LV-sydänlihaksen relaksaatiota .
vaikka diastolinen toimintahäiriö on laajalle levinnyt ilmiö jopa 70%: lla leikkauksen jälkeisistä sydänpotilaista , pelkkä diastolinen toimintahäiriö ei riitä selittämään akuutin sydämen vajaatoiminnan kehittymistä. Muiden kliinisten tilojen, kuten eteisvärinän (AF), heikentyneen sepelvaltimon verenkierron ja valtimon hypertension, asettamisessa diastolinen toimintahäiriö voi johtaa dekompensoituneeseen tilaan, ja siten uskotaan olevan varhainen merkki sydänlihasiskemiasta . LV: n diastolisen ja systolisen toiminnan välinen dynaaminen suhde vaikuttaa myös lohf-potilaiden diastoliseen toimintahäiriöön. Inotrooppisen katekoliamiinin stimulaatio vaikuttaa sekä diastoliin että systoliin ja voi parantaa diastolista toimintahäiriötä. Masentunut LVEF johtaa end-systolisen tilavuuden kasvuun ja pidentää sydämen syklin diastolista vaihetta .
RV: n toimintahäiriö
LoHF: ssä, erityisesti sepelvaltimoleikkauksen jälkeen, RV: n toimintahäiriön pääasiallisia patofysiologisia mekanismeja ovat lisääntynyt esikuormitus, lisääntynyt jälkikuormitus, heikentynyt oikean sepelvaltimon perfuusio ja supistumiskyvyn heikkeneminen . Toisin kuin vasen sepelvaltimo, oikean sepelvaltimon perfuusio tapahtuu sekä diastolen että systolen aikana. PH: n esiintyminen aiheuttaa RV-paineen nousun, joka johtaa oikean sepelvaltimon perfuusion vähenemiseen, mikä selittää optimaalisen vasemman ja oikean sepelvaltimon verenkierron tärkeyden . Potilailla, joille on tehty sepelvaltimoleikkaus, RV-toimintahäiriö voi kehittyä mekanismien yhdistelmän seurauksena. Perioperatiivinen RV iskemia ja infarkti ovat tärkeimmät syyt heikentynyt RV supistumiskyky. Tricuspid tai pulmonic regurgitaatio re yleisiä syitä lisääntynyt tilavuus esikuormitus kun taas vasemmanpuoleinen läppävika tai kardiomyopatia, PH tai keuhkoembolia (PE), akuutti hengitysvaikeusoireyhtymä ja korkea positiivinen paine ilmanvaihto ovat yleisiä syitä paineen ylikuormitus . Koska RV normaalisti mahdollistaa keuhkojen verisuoniston matalapaineisen perfuusion, se on erittäin herkkä jopa kohtalaiselle keuhkovaltimopaineen nousulle (PAP). RV: n vajaatoiminta voi kehittyä pH: n asettamisessa tai heikentyneessä supistumiskyvyssä, joka liittyy RV: n laajenemisen nopeaan etenemiseen, mikä johtaa kasvaneeseen loppudiastoliseen RV: n paineeseen . Nämä fysiologiset muutokset voivat aiheuttaa kammioiden väliseinän siirtymän kohti jo vajaatäytettyä LV-kammiota ja siten vähentää LV-esijännitystä ja vähentää CO-arvoa .
riskitekijät
LoHF: n riskitekijät ovat edelleen alitutkittua aluetta. HF: llä tehdyistä kliinisistä tutkimuksista ja leikkauksen jälkeisistä LCOS-potilaista saadut vähäiset tiedot antavat kuitenkin arvokasta tietoa LoHF: n riskitekijöistä ja ennustajista. Analysoitaessa 452 : ta sairaalahoitopotilasta, joilla oli dekompensoitunut HF ja alhainen sydämen tuotos, lohf: n merkittäviä riskitekijöitä olivat Chagasin tauti (suhteellinen riski: 3, 66), alentunut ejektiofraktio (RR: 2, 41), hyponatremia (RR: 1, 62) ja munuaisten toimintahäiriö (RR: 1, 92) . Leikkauksen jälkeisen LoHF: n riskitekijöitä ovat heikentynyt LV-toiminta (< 50%), pumpun ohitusleikkaus, hätäleikkaus tai kardiopulmonaalinen ohitusleikkaus (CPB), epätäydellinen revaskularisaatio, Ikä > 65 vuotta sekä diabetes mellituksen ja pre-operatiivisen munuaisten toimintahäiriön yhteisesiintyminen . Potilaan ja leikkauksen riskitekijöiden lisäksi lohf: n biokemiallisia ennusteita leikkauksen jälkeisillä potilailla ovat alhainen hemoglobiinitaso, kokonaislymfosyyttien määrä < 2000 solua/µL sekä seerumin natriureettisten peptidien preoperatiivinen määrä . Viimeisten kahden vuosikymmenen aikana joidenkin tunnistettujen riskitekijöiden trendeissä on tapahtunut muutoksia. Tekijät, kuten verenpainetauti, naissukupuoli, kolmoissuonitauti ja vasen pääsairaus, eivät ole enää tilastollisesti merkitseviä, kun taas masentuneeseen esileikkausfraktioon liittyvä riski on kaksinkertaistunut .
diagnoosi
LoHF-potilaille ei ole olemassa konsensusohjeita tai todistettuja diagnostisia kriteerejä. Lisäksi kliiniset merkit ja oireet ovat epäspesifisiä. Koska standardoituja ohjeita ei ole, diagnoosi perustuu yleensä hyväksyttyyn hemodynaamisten ja fysiologisten poikkeamien keräämiseen, mikä on hyödyllistä lohf: n kliinisen epäilyn lisäämiseksi . Pelkkä lohf-diagnoosi ei usein riitä. Myös vähäisen tuotantotilan syy on selvitettävä. Joissakin syitä matalan tuotoksen tila, kuten PE tai MI, hoitoon perimmäinen syy on tärkein näkökohta ja siten on välttämätöntä tehdä diagnoosi. Koska LoHF-potilaat ovat usein epästabiileja, on myös tavallista, että kliininen arviointi, diagnoosi ja hoito tapahtuvat samanaikaisesti enemmän akuuttihoidossa .
merkit ja oireet
Matala sydämen lähtöteho akuutin dekompensoidun sydämen vajaatoiminnan ilmentymänä on melko harvinainen, sillä vain 8, 9-9, 6%: lla sairaalahoitoa saaneista HF-potilaista esiintyy . LoHF: llä voi olla monia kliinisiä piirteitä CHF: n kanssa, mutta on merkittäviä eroja, jotka voivat tukea tai ohjata myöhempiä diagnostisia päätöksiä. Liiallinen väsymys ja lisääntynyt liikunta-intoleranssi ovat tärkeitä alkumerkkejä, jotka LoHF-potilaat ovat huomanneet jo ennen diagnoosia . Lisäksi LoHF-potilailla esiintyy yleisesti agitaatiota, sekavuutta ja/tai tajunnan tason laskua, kylmyyttä/vasokonstriktoituneita perifeerisiä alueita tai viivästynyttä kapillaarien täyttöaikaa, hypotensiota, takykardiaa tai bradykardiaa, heikkoa pulssia, kohonnutta kaulalaskimopainetta, hengenahdistusta ja hypoksemiaa sekä oliguriaa/anuriaa . Nämä merkit ja oireet voivat vaihdella alhaisen perfuusion ja ruuhkautumisen välillä HF-potilailla (Taulukko 2).
Taulukko 2. Alhaisen perfuusion oireet ja merkit vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: ESC: n vuoden 2016 ohjeissa HF: n diagnosoinnista ja hoidosta korostetaan, että on tärkeää saada yksityiskohtainen potilashistoria ja lääkärintarkastus kaikille potilaille, joilla epäillään olevan HF . Potilaan tai hänen sukulaistensa ja ystäviensä, jos potilas on liian sairas, antamien yksityiskohtaisten tietojen hankkimisessa olisi keskityttävä saamaan tietoa oireista, aiemmista ja nykyisistä sydänsairauksista ja sydämen ulkopuolisista sairauksista, jotka voivat saostuttaa tai pahentaa HF: ää, altistumisesta HF: n tai alhaisen tuotoksen riskitekijöille sekä aikaisempien ja nykyisten sairauksien lääkehistoriasta . Potilashistorian lisäksi kaikille LoHF-potilaille suositellaan lääkärintarkastusta hemodynaamisen, perifeerisen perfuusion, ruuhkautumisen, taustalla olevan etiologian ja läppäpatologian kliinisten indikaattorien määrittämiseksi. Hemodynaamisia parametreja ovat muun muassa verenpaine, HR ja sydämen rytmi, laukkarytmi, happisaturaatio ja hengitysnopeus . Perifeerisen perfuusion testeihin tulee kuulua tajunnan taso, perifeerinen ihon/keskus lämpötila, kapillaarien täyttöaika ja virtsaneritys. Ruuhkatestit sisältävät kohonneen kaulalaskimopaineen, perifeerisen/keuhkopöhön, hepatomegalian, askites ja pleuraeffuusiot. Taustalla olevan etiologian testeihin on sisällyttävä sydän-ja verisuonitutkimus sekä sydänäänet ja sivuäänet. Lopuksi, näyttöä läppävika toimintahäiriö olisi sisällyttävä perikardiaalinen hiero ja todisteita perikardiaalinen effuusio kanssa tai ilman sydämen tamponaatio .
potilashistorian ja fyysisen tutkimuksen yhdistelmä on osoittautunut korvaamattomaksi hemodynaamisen tilan arvioinnissa ja LoHF: n tunnistamisessa . Vuonna 1976 Forrester et al. tehty fyysinen tutkimus potilaille, joilla on akuutti sydäninfarkti ja tunnistettu neljä hemodynaamista profiilia (A, B, L ja C) kuten kuvassa 2. Hemodynaamiset profiilit perustuvat keuhkojen tukkoisuuden esiintymiseen tai puuttumiseen (keuhkojen kapillaarikiilapaine > tai ≤ 18 mmHg) ja perfuusion riittävyyteen (CI > 2, 2 L/min/m2). Profiili A ei sisällä ruuhkautumista/hypoperfuusiota; profiili B ruuhkautumista ilman hypoperfuusiota; profiili C hypoperfuusiota ilman ruuhkautumista; ja profiili L ruuhkautumista ja hypoperfuusiota . LoHF-potilaat kuuluvat profiileihin L ja C (hypoperfuusio ± ruuhkautuminen perustuu nohria et al. osoitetaan, että Profiilin L keskimääräinen luottamusväli on 1, 6 L/min/m2 ja C 1, 9 L/min/m2.
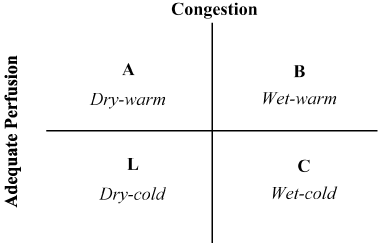
kuva 2. Akuutin dekompensoituneen sydämen vajaatoiminnan kliinisen Profiilin kaaviokuva
tukkoisuus arvioidaan ortopedian, jugulaarisen laskimoiden laajenemisen, keuhkojen rales: n, hepatojugulaarisen refluksoinnin, askitesin, perifeerisen turvotuksen, vatsan refluksoinnin ja Valsalvan neliöaallon perusteella. Vähäistä perfuusiota arvioitiin ahtaalla pulssipaineella, pulssimuutoksilla, kylmillä raajoilla, ehkä uneliaisuudella, seerumin natriumpitoisuuden laskulla ja munuaisten toiminnan heikkenemisellä. Mukautettu nohria, et al.
elektrokardiogrammi (EKG): sekä AHA-että ESC-ohjeissa suositellaan EKG: n tekemistä mahdollisimman varhaisessa vaiheessa kaikille potilaille, joiden epäillään sairastavan EKG: tä. EKG voi osoittaa erilaisia poikkeavuuksia, ja on hyvin epätodennäköistä, että se olisi normaali HF-potilailla. Se voi myös antaa näyttöä taustalla olevasta sydämen toimintahäiriöiden etiologiasta, mukaan lukien bradykardia, eteis-kammiokatkos, sinustakykardia, eteisen tai kammion takyarytmia, iskemia, LV-hypertrofia ja pienjännitekompleksit .
Peruslaboratoriokokeet: AHA-ja ESC-ohjeissa suositellaan myös peruslaboratoriokokeita alustavassa kliinisessä arvioinnissa tukemaan HF: n tai vähäisen tuotoksen syyn diagnosointia. Verikokeet tulee ottaa kaikilta epäillyiltä HF-potilailta. Hemoglobiini (Hb > 10 g/dL) viittaa optimaaliseen hapensaantiin kudoksiin), krooninen anemia on yleistä kroonisessa HF: ssä ja valkosolujen selvästi lisääntynyt määrä herättää epäilyksiä vaihtoehtoisesta diagnoosista. Seerumin elektrolyyttitestit kalium -, magnesium-ja kalsiumpitoisuuksien määrittämiseksi. Urea-ja kreatiniinitestit munuaisten hypoperfuusion ja munuaisten toimintahäiriöiden arvioimiseksi. Testit maksan vajaatoiminta, jotka viittaavat heikentynyt RV ja / tai maksan tukkoisuutta. Glukoositesti sydämen toimintaa heikentävän hypoglykemian varalta. Kilpirauhasen toimintakokeet hypo – tai hyperyroidismin varalta, jotka voivat aiheuttaa luontaisen sydäninfarktin. Lopuksi testataan seerumin natriureettisia peptidejä, joiden kohonneet tasot osoittavat lisääntynyttä kammion seinämän rasitusta, mutta jotka eivät havaitse äkillisiä muutoksia kammioiden täyttöpaineissa niiden pitkän puoliintumisajan vuoksi .
sydämen kuvantamistestit: sydämen kuvantamisella on keskeinen rooli sydämen vajaatoiminnan diagnosoinnissa sekä seuranta-ja ohjaushoidossa. Kaikukardiografia on suositeltavin modaalisuus tarkkuuden, saatavuuden, turvallisuuden ja kustannustehokkuuden vuoksi . Sitä voidaan täydentää muilla kuvantamistavoilla, jotka on valittu sen perusteella, pystyvätkö ne vastaamaan tiettyihin kliinisiin kysymyksiin vasta-aiheita ja riskejä harkittaessa .
kaikukardiografia: kaikukardiografiaa suositellaan voimakkaasti kaikille epäillyille potilaille, koska sillä voidaan varmistaa tai sulkea pois lohf: n kliininen diagnoosi, arvioida SV: tä ja sen vaihteluita sekä selvittää alhaisen tuotostilan syy . Tranthorasinen kaikukardiografia on tehtävä mahdollisimman pian sen jälkeen, kun sydämen vajaatoiminta on todettu kliinisesti. Paitsi että se mittaa systolisen ja diastolisen toimintahäiriön laajuutta, se tarjoaa myös arvokasta tietoa kammion morfologiasta, läppävian toimintahäiriöistä, sydänlihaksen ja perikardiaalisen sairauden sekä alueellisten seinäliikkeiden poikkeavuuksista . Kaikukardiografiassa systolista toimintaa arvioidaan mittaamalla LEVF, jossa > 45-50% pidetään normaalina. Toisaalta diastolista toimintaa arvioidaan mitraaleilla virtauskuvioissa, keuhkolaskimovirtauksella ja kudosdopplerilla mitraalirenkaassa, kun taas CO ja SV arvioidaan Doppler-periaatteella. Keuhkovaltimopaine (Pap) voidaan arvioida mittaamalla regurgitate jet velocity. Korkea Papa, kun RV on laajentunut ja väliseinät litistyvät tai taipuvat LV: hen, mikä osoittaa RV: n paineen äkillistä nousua ja lisää kliinistä epäilyä PE: stä alhaisen lähtötilan aiheuttajana .
rintakehän röntgenkuvaus: Keuhkoröntgeniä voidaan harkita potilailla, joiden epäillään sairastavan LoHF: ää. Tärkeitä indikaattoreita, joita tulisi harkita arviointia varten, ovat suurentunut sydän, joka osoittaa kardiomegaliaa tai LV-hypertrofiaa; keuhkolaskimoiden tukkoisuus, joka osoittaa kohonnutta LV-täyttöpainetta; ja pleuraeffuusio, joka viittaa kohonneeseen LV-paineeseen, keuhkoemboliaan tai sydänleikkauksen jälkeiseen (.
sepelvaltimoiden varjoainekuvaus: Lohf-potilaiden sepelvaltimoiden varjoainekuvausta koskevien käyttöaiheiden tulee olla sopusoinnussa HF: ää koskevien konsensusohjeiden suosituksen kanssa . Sydämen vajaatoimintapotilailla, joilla esiintyy rintakipua ja merkkejä sydäninfarktista (St-noususta) EKG: ssä, revaskularisaatio on tehtävä primaarisella perkutaanisella sepelvaltimotoimenpiteellä mahdollisimman pian. Sepelvaltimoiden varjoainekuvausta tulee harkita myös potilailla, joilla on iskeemisen etiologian aiheuttama sydänpysähdyksen jälkeinen sairaus, jos on näyttöä sydämen vajaatoiminnasta, ja potilailla, jotka ovat toipuneet alhaisen tuotoksen tilasta, kun syytä ei ole selvitetty .
kliininen hoito
LoHF: n esiintyminen on erittäin korkean riskin tila, joka vaatii nopeaa hoitoa, mutta siitä puuttuu standardoidut ohjeet kliiniselle hoidolle . Siksi lääkärit yleensä harkitsevat yksilöllistä patofysiologiaa valitakseen sopivimman hoitostrategian . Akuuttilohf-potilailla vuoden 2016 ESC HF-ohjeissa suositellaan hemodynaamisten profiilien käyttöä (verekkyyden ja perfuusion riittävyyden perusteella) kliinisen hoidon ohjaamiseksi . Lohf-potilailla, joilla on profiili L (ei ruuhkia, mutta hypoperfusoitu) ja profiili C (sekä ruuhkia että hypoperfusoitu) ja jotka ovat akuutissa dekompensaatiotilassa, kiireellisiä hoitotavoitteita voivat olla potilaiden elvyttäminen, hapetuksen palauttaminen, elimen perfuusion parantaminen ja hemodynaamisen optimointi (aivohalvauksen tilavuus ja CO) sekä oireiden ratkaiseminen. Muita myöhempiä tavoitteita ovat optimaalinen seuranta ja selvittää perimmäinen syy alhainen sydämen tuotos ja hoitoon syy, jos palautuva . Tällä hetkellä LoHF: n käytettävissä olevia terapeuttisia tavoitteita ovat kudosten hapetuksen optimointi, verenkierron vakauttaminen ja pienitehoisen tilan palautuvien syiden hoito (kuva 3).
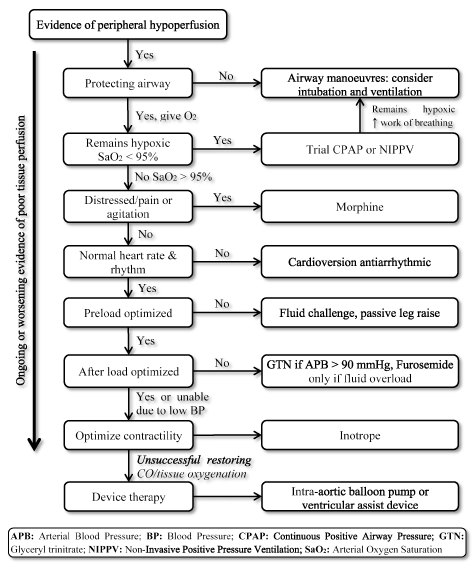
kuva 3. Low-output heart failure
Treatment algorithm for low-output heart failure
Treatment of LoHF-hoidon tavoitteena on parantaa kudosten hapetusta ja vakauttaa verenkiertoa kudosperfuusion jatkuvan tai pahenevan oireilun perusteella. Hoito aloitetaan parantamalla ilmanvaihtoa käyttämällä korkean virtauksen happea, jatkuvaa positiivista hengitystiepainetta (CPAP) tai ei-invasiivista positiivista painetta (NIPPV). Jos ei onnistu, kardioversion tai rytmihäiriölääkkeitä annetaan normalisoimaan syke, nesteen haaste optimoida esikuormitus ja / tai vasodilataattorit ja inotropes manipuloida ja parantaa supistumiskykyä vastaavasti. Jos aikaisempi ilmanvaihto ja lääkitys eivät onnistu palauttamaan sydämen tuotantoa ja/tai kudosten hapetusta, voidaan harkita laitehoitoa, jossa käytetään aortan sisäistä ilmapallopumppua tai kammion apuvälineitä
optimoi kudosten hapetus (hengitysstrategiat)
Lohf-potilaiden kliininen hoito aloitetaan usein hengitysteiden, hengityksen ja verenkierron arvioinnilla perifeerisen hypoperfuusion osoittamiseksi. Hengityskonestrategiat, kuten nielun tai nenänielun hengitystiet, ovat yleisiä apuvälineitä, joita käytetään hengitysteiden avoimuuden palauttamiseen tai ylläpitämiseen LoHF-potilailla, joiden tajunnan taso on alentunut aivojen perfuusion vähenemisen vuoksi. Endotrakeaalisen intubaation lisäämistä tulee harkita, jos potilaan hengitystiet ovat edelleen heikentyneet . Jos potilaat ovat edelleen hypoksisia (SaO2 < 95%), voidaan harkita hapensaannin maksimointia käyttämällä korkeavirtaushappea, jatkuvaa positiivista hengitystiepainetta (CPAP) tai ei-invasiivista positiivista painetuuletusta (NIPPV). Jos potilaan tila ei parane, voidaan harkita intubointia tai ilmanvaihtoa .
stabiloi verenkiertoa
sydämen ulostulo (CO) on HR: n ja SV: n funktio. SV puolestaan riippuu neljästä kiertomuuttujasta-sykkeestä, esijännityksestä, supistuvuudesta ja jälkikuormituksesta. Optimoimalla kaikki nämä muuttujat parantaa CO LoHF potilailla . Kliinisessä ympäristössä, strategioita lisätä CO riippuu perimmäinen syy ja vaikuttaa liikkeeseen muuttuja . Kliinisiin interventioihin kuuluvat volyymin säätö, farmakologinen tuki ja laitehoito.
syke / rytmi: Osana kehon fysiologista vastetta HR: n lisääminen lisää CO. Liian nopea tai hidas HR vaikuttaa haitallisesti CO. Lohf-potilaille, joilla on takykardia (liian nopea leposyke > 100 bpm) ja jotka ovat ahdistuneita, levottomia ja hengenahdistusta, morfiinia voidaan antaa hengenahdistuksen, kivun ja levottomuuden lievittämiseen sekä lievänä venodilaattorina jälkikuormituksen vähentämiseen erityisesti CPAP-tai NIPPV-potilailla . Jos HR < 40 bpm ja näyttöä hemodynaamisesta kompromissista ja/tai heikentyneestä CO-pitoisuudesta, on suoritettava HR: ää lisäävä lääkitys (atropiini ja antikolinergit ) tai toimenpiteet, kuten transkutaaninen/transvenoottinen tahdistus. Kiireellistä sähköistä sydämen rytminsiirtoa tulee harkita valitussa LoHF: ssä, johon liittyy kammiotakykardia/supraventrikulaarinen takykardia tai nopea AF, johon liittyy merkkejä kardiovaskulaarisesta heikentymisestä .
optimoi esijännitys (Tilavuussäädöt): esijännityksen mittaaminen on välttämätöntä sen optimoimiseksi. Sitä suositellaan potilaille, joilla on kliinistä näyttöä perifeerisen perfuusion heikentymisestä. Esikuormitusvasteen arvioimiseksi on suoritettava nestehaaste. Infusoi nopeasti 250 ml nestettä (kristalloidia tai kolloidia) yli viiden minuutin ajan ja arvioi objektiivisesti vaikutusta SV: hen. Jos vaikutus on lisäys tai lasku > 10%, potilaan tulee jatkaa nestebolusten käyttöä esikuormituksen optimoimiseksi, kunnes potilas ei enää reagoi nesteeseen . Potilailla, joilla on merkkejä ruuhkia ja keuhkopöhö, jotka eivät vaadi fluid bolus, passiivinen jalka nostaa voidaan tehdä-nosto potilaan jalka 45 astetta sulkea pois nesteen haaste. Jos vaste on suotuisa, voidaan antaa todellinen nestehaaste .
manipuloi afterload (farmakologinen tuki): Afterload on vastus, jota vastaan kammio syöksee verta, joskus arvioitu SVR. Jälkikuormitusta tulee vähentää LoHF-potilailla, joilla on suuri jälkikuormitus, Alhainen CO, näyttöä heikosta perifeerisestä perfuusiosta ja keuhkoedeemasta. Farmakologista tukea vasodilataattoreilla tulee antaa LoHF-potilaille, joiden systolinen verenpaine on ≥110 mmHg. Vasodilataattoreita ei suositella potilaille, joiden systolinen verenpaine < 90 mmHG ja valtimopaine < 65 mmHg, koska hypotensio voi vaikeuttaa elinten perfuusiota. Näillä potilailla inotrooppia suositellaan ensimmäiseksi hoitolinjaksi .
paranna supistumiskykyä (farmakologinen tuki): Jos potilaalla ilmenee edelleen merkkejä kudoshypoperfuusiosta tai heikentyneestä hapensaannista huolimatta sydämen sykkeen, esikuormituksen ja jälkikuormituksen toimenpiteistä, on harkittava supistumiskykyä parantavaa hoitoa. Samalla hapensaannin optimointia tulee jatkaa siten, että hemoglobiini on ≥10 g/dl ja että varmistetaan optimaalinen hapen kyllästyminen (SaO2). Sydänlihaksen supistuvuuteen vaikuttavat tekijät ovat hyperkalemia, hypomagnesemia, hypokalsemia, vaikea asidoosi, hypoksia ja hypoglykemia, jotka on korjattava. Inotrooppeja suositellaan supistuvuuden ja sen jälkeen CO: n parantamiseksi LoHF-potilailla, joilla on alhainen verenpaine ja/tai alhainen CI, jos perifeerisen perfuusion tai tukkoisuuden merkkejä esiintyy . Dobutamiinia (inotrooppi) käyttävää farmakologista tukea tulee kuitenkin käyttää varoen potilailla, joilla on takykardia tai AF, koska se lisää AV-solmun johtumista ja voi saostuttaa nopeita kammiorytmejä . Toisaalta levosimendaania suositellaan LoHF-potilaille, joilla on akuutti sydänlihas iskeeminen tai sydänleikkauksen jälkeen, koska se ei lisää sydänlihaksen hapentarvetta . Inotrooppien pitkäaikainen vaikutus voi olla haitallinen, joten niiden käyttö tulisi lopettaa, kun stabiilisuus on saavutettu. Vasopressorit eivät saisi olla ensilinjan lääkkeitä alhaisen tuotoksen tiloissa, koska ne lisäävät SVR: ää ja myöhemmin heikentävät CO: ta. Vasopressorien ja inotroopin kaksoishoitoa suositellaan kuitenkin potilaille, joilla on sepsis alhaisen tuotostilan perussyynä .
laitehoito: LoHF-potilailla tulee harkita laitehoitoa, jos optimaaliset lääkehoidot eivät ole onnistuneet palauttamaan solujen hapetusta ja hapetusta. Yleisiä laitehoitoja ovat aortan sisäinen pallopumppu (IABP) ja kammion avustinlaite (vad). IABP: n käyttö on yleistä lohf-potilailla, joilla on iskeeminen sydänsairaus, ennen tai jälkeen perkutaanisen toimenpiteen tai sydänleikkauksen. IABP koostuu ilmapallo työnnetään aortan kautta reisivaltimo. Ilmapallo täyttyy diastolen aikana ja deflatoituu systolen aikana, mikä lisää diastolista BP: tä ja siten sepelvaltimon perfuusiota, ja vähentää jälkikuormitusta, mikä lisää CO: ta . Toisaalta VAD: n käyttö on harvinaista. Sitä voidaan käyttää vain erikoistuneissa keskuksissa. Sitä käytetään yleisesti siltana sydämensiirtoon potilailla, joiden elämänlaatu on suotuisa, tai toipumiseen potilailla, joilla on akuutti sydänlihastulehdus .
perussyiden hoitaminen
jotkin lohf-potilailla esiintyvän alhaisen tuotostilan syyt voidaan korjata tietyillä hoidoilla. Korjaantuvat syyt tulee tunnistaa kliinisen tutkimuksen alkuvaiheessa. Näitä syitä ovat akuutti sydäninfarkti, sydämen tamponaatio, paineilmarinta, keuhkoembolia ja akuutti venttiilin vajaatoiminta . (Taulukko 3).
diagnoosin ja kliinisen hoidon Meta-analyysi
lohf: n kliinisen diagnoosin perustana ovat olleet KAIKUKARDIOGRAFISET todisteet LV/RV: n systolisesta toimintahäiriöstä ja / tai LV: n diastolisesta toimintahäiriöstä sekä todisteet alentuneesta CO-ja SvO2: sta . Hemodynaamisia profiileja, jotka perustuvat tukkoisuuden ja perfuusion mittauksiin, on käytetty akuuttien HF-potilaiden luokittelussa neljään profiiliin: kuiva-lämmin (A), märkä-lämmin (B), kuiva-kylmä (L) ja märkä-kylmä (C), ja ne ovat hyödyllisiä LoHF-potilaiden tunnistamisessa . LoHF-potilaat on luokiteltu profiileihin (L) ja (C) sen mukaan, onko potilaalla/ei ole verekkyyttä ja/tai onko perifeerinen perfuusio riittämätön . Nämä kaksi hemodynaamista profiilia ovat muodostaneet perustan LoHF-potilaiden valinnalle kliinisissä tutkimuksissa sekä tarjoavat yksinkertaisen vuodeosaston arvioinnin, joka auttaa luokittelemaan potilaat esitysajankohtana ja ohjaamaan aloitushoitojen valintaa . Tämän meta-analyysin tavoitteena on koota julkaistua näyttöä LoHF-potilaiden yleisistä diagnostisista ominaisuuksista ja Hoitotuloksista.
Hakustrategia
kolmesta suuresta online-tietokannasta (PubMed, EMBASE ja Cochrane) haettiin systemaattisesti alusta joulukuuhun 2018 LoHF: n diagnosointia ja kliinistä hoitoa selvittäviä tutkimuksia varten. Jotta ei jätettäisi huomiotta tutkimuksia, joissa Lohfia ei mainittu otsikossa tai abstraktissa, mukaan otettiin ensimmäiset 200 merkityksellisyysjärjestyksessä olevaa artikkelia, jotka haettiin Kokotekstisellä Google Scholar-haulla. Julkaisuaikaa tai kielirajoituksia ei sovellettu. Lisätutkimukset yksilöitiin hakemalla manuaalisesti mukaan otettujen tutkimusten Lähdeluettelo sekä asiaankuuluvat arviointiartikkelit, joihin sitten sovellettiin sisällyttämisperusteita. Hakukriteereinä olivat kiinnostava populaatio (lohf-tai LCOS-potilaat), kiinnostavat diagnostiset testit (kaikukardiografia ja hemodynaamiset profiilit) ja kiinnostavat toimenpiteet (ventilaattoristrategiat, volyymin säätö, farmakologinen tuki ja laitehoito). Tutkimukset otettiin mukaan, jos ne täyttivät seuraavat kriteerit: a) mukana LoHF-potilaita; (b) diagnosoitu ekokardiografialla ja hemodynaamisilla profiileilla; (C) hoidetuilla potilailla hemodynaamisen stabiloinnin vuoksi; ja (d) raportoidut hoitotulokset. Tapauksissa, joissa raportoitiin päällekkäisiä tietoja, mukaan otettiin vain tutkimus, jossa oli eniten potilaita. Konferenssien tiivistelmät, tapauskertomukset ja katsausartikkelit jätettiin pois.
Tutkimusvalinta
kuva 4 kuvaa haku-ja seulontaprosessia, jota käytettiin tukikelpoisten tutkimusten sisällyttämiseen. Kaksi arvioijaa seuloi itsenäisesti kaikki systemaattisesta verkkohausta haetut otsikot ja tiivistelmät. Kokotekstihakuun sisällytettiin abstrakteja, jotka sisälsivät väestöä, interventioita ja kiinnostavia tuloksia. Tämän jälkeen molemmat arvioijat tarkastelivat myös itsenäisesti kokotekstisiä artikkeleita sisällyttämisperusteisiin nähden. Ristiriitatilanteissa se ratkaistiin keskustelemalla ja konsensuksella.

kuva 4. Kirjallisuudenhaku-ja inkluusioprosessin vuokaavio
tiedonkeruu
kaksi arvioijaa irrotti itsenäisesti tietoja mukana olleista tutkimuksista ja mahdolliset ristiriidat ratkaistiin konsensuksella. Tärkeimmät kerätyt tiedot olivat kaikukardiografiset ja hemodynaamiset profiilitiedot sekä käytetty hoito ja hoidon tulos hemodynaamisessa (sydänindeksi, PCWP) ja kuolleisuudessa. Näiden päätietojen lisäksi molemmat arvioijat poimivat myös tietoja tutkimuksen ominaisuuksista, potilaiden ominaisuuksista ja seurannan kestosta (Taulukko 4).
tilastollinen analyysi
useammassa kuin yhdessä tutkimuksessa raportoidut kiinnostuksen tulokset ovat sydänindeksi, PCWP ja kuolleisuus. Kunkin tuloksen osalta yhteenvetotilastot (keskiarvo ± keskihajonta) ennen intervention poistoa ja sen jälkeen tai lähtötilanteen ja hoidon jälkeisen eron. Nämä yhteenvetotilastot on poimittu erikseen hoito-ja verrokkiryhmistä / lumelääkeryhmistä. Diagnostisia tuloksia ja hoidon vaikutuksia mitattiin keskiarvojen eroilla ennen interventiota ja sen jälkeen sekä siihen liittyvällä 95 prosentin luottamusvälillä. Metsäpalstoilla tarkasteltiin silmämääräisesti eri tutkimusten heterogeenisuutta (I2). Yhdistetty diagnostinen ja hoidon vaikutus ja siihen liittyvä 95%: n luottamusväli arvioitiin käyttämällä kiinteää vaikutusta (I2 < 49%) tai satunnaisvaikutusmallia (I2 > 50%). P-arvoa > 0, 05 pidettiin tilastollisesti merkitsevänä.
tulokset
Tutkimusominaisuudet
kaksitoista (12) satunnaistettua kontrolloitua tutkimusta (rcts) täyttivät osallistumiskriteerit. Seitsemään (7) tutkimukseen otettiin LoHF-potilaita ja muihin viiteen (5) HF-potilaita, joille oli tehty sydänleikkaus, jonka sydämen teho oli alhainen. Suurin osa julkaistuista kliinisistä tutkimuksista (10) tutki lääkitystä vertaamalla erityyppisten inotrooppien vaikutusta hemodynaamiseen ja kuoleman ehkäisyyn: vain dobutamiini , dobutamiini ja dopamiini ; levosimendaani ja dobutamiini sekä levosimendaani ja lumelääke . Kahdesta muusta kliinisestä tutkimuksesta kummassakin tutkittiin vasodilataattoria (nitroprussidi) ja lumelääkettä sekä laitehoitoa (iabp) ja inotrooppia (levosimendaani) yksin tai yhdessä IAPB: n kanssa . Yhteensä 12 kliiniseen tutkimukseen otettiin 3 738 potilasta, joiden keski-ikä oli 64 vuotta (vaihteluväli = 55-74 vuotta) ja suurin osa heistä oli miehiä (78%).
tulosten synteesi
LoHF: n diagnoositiedot olivat epäjohdonmukaisia. Kahdentoista kliinisen tutkimuksen aikana LoHF: lle ei syntynyt yhteistä määritelmää, joka olisi ollut hyödyllinen diagnoosin ohjaamiseksi. Hemodynaamisia kriteerejä , joita käytettiin potilaiden sisällyttämiseksi tutkimuksiin, olivat CI < 2, 0 L/min/m2, CI < 2, 2 L/min/m2 tai CI < 2, 5 L/min/m2 ja PCWP > 15 mmHg tai ≥18 mmHg . Määritelmä vaihteli myös eri tutkimuksissa – leikkauksen jälkeinen tila, johon liittyi hypotensiota (systolinen verenpaine < 90 mmHg, kun > 30 min) tai inotrooppisen tuen tarve systolisen verenpaineen ylläpitämiseksi > 90 mmHg ja loppuelimen hypoperfuusio (kylmät periferiat, virtsaneritys < 30 ml/h) . Kardiogeenistä sokkia on kuvattu monimutkaiseksi oireyhtymäksi, johon liittyy akuutti LV-toimintahäiriö, vähentynyt CO-arvo, hypotensio ja kudoshypoperfuusio .
kuvissa 5 ja 6 esitetään sydänindeksin standardoitu keskiarvo lähtötilanteessa ja inotrooppisen hoidon jälkeen tai vasodilataattorihoidon jälkeen. Sydänindeksi nousi lähtötilanteessa keskiarvosta 1, 93 (95%: n luottamusväli: 1, 91-1, 95) hoidon jälkeiseen keskiarvoon 2, 82 (95%: n luottamusväli: 2, 80-2, 84). Kuvassa 7 esitetään sydänindeksin standardikeskiarvo (SMD) levosimendaanilla ja dobutamiinilla hoidetun hoidon jälkeen. Levosimendaanin sydänindeksi on korkeampi kuin dobutamiinin (SMD: 2, 82; 95% CI: 2, 54-3, 10). Profylaktisena LoHF: ää vastaan leikkauksen jälkeisillä potilailla levosimendaani-infuusiolla anestesian jälkeen saavutettiin korkeampi sydänindeksi (2, 57) kuin ennen leikkausta annetulla IABP: llä (2, 3) tai levosimendaanin yhdistelmällä (2, 4). Kuvassa 8 on levosimendaanin ja lumelääkkeen välinen kuolleisuus metsäpalstalla. Levosimendaanilla oli pienempi kuolleisuus kuin lumelääkkeellä (Kerroinsuhde : 0, 83; 95%: n luottamusväli: 0, 59-1, 18), mutta ero ei ollut tilastollisesti merkitsevä (p=0, 30). Lopullinen, kuva 9 osoittaa lisäksi, että levosimendaanin kuolleisuus on pienempi kuin dobutamiinin (tai: 0, 65; 95%: n luottamusväli: 0, 39-1.08) but the difference was not statistically significant (p=0.10).
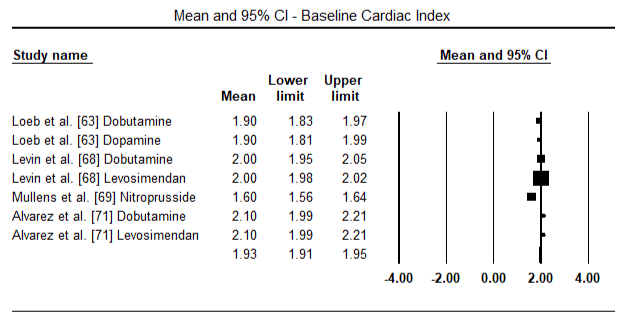
Figure 5. Mean baseline cardiac index
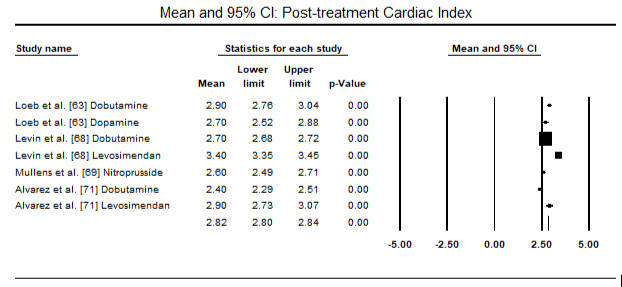
Figure 6. Mean post-treatment cardiac index
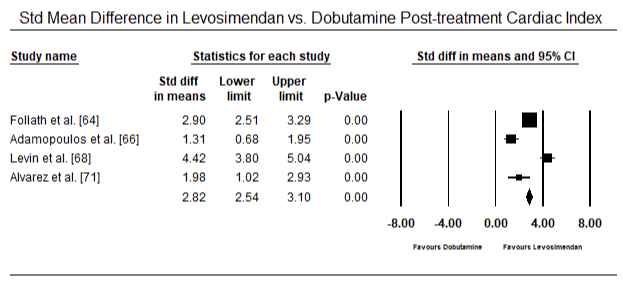
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
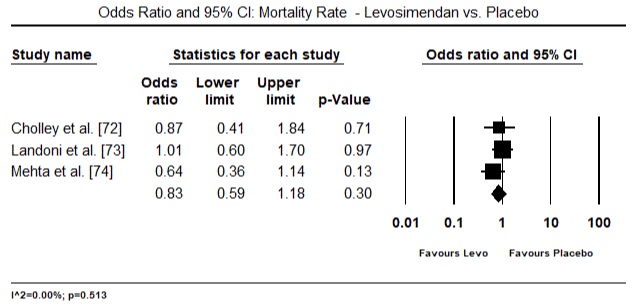
Figure 8. Mortality rate between levosimendan and placebo
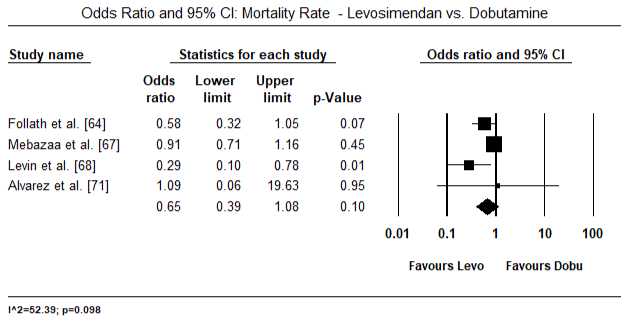
Figure 9. Kuolleisuus levosimendaanin ja dobutamiinin välillä
Keskustelu löydöksistä
tässä systemaattisessa katsauksessa ja meta-analyysissä arvioitiin LoHF-potilailla yleisiä diagnostisia ominaisuuksia ja lääketieteellisen ja laitehoidon (iabp) hoitotuloksia. Tulokset osoittavat, että LoHF-potilailla ei ole laajalti hyväksyttyjä tai standardoituja diagnoosiominaisuuksia. Vaikka LoHF-potilailla voi olla useita ominaisuuksia, kuten sydänindeksi, PCWP, systolinen verenpaine ja SvO2, jotka viittaavat kliiniseen diagnoosiin tai tukevat sitä, kaikilla näillä ominaisuuksilla on erilaiset cut-off-arvot eri tutkimuksissa. Sydänindeksillä, joka on yleisin low-output-tilan osoittava kliininen piirre LoHF: ssä, on kolme cut-off-arvoa: < 2, 0 L/min/m2, < 2, 2 L/min/m2 tai < 2, 5 l/min/m2 . Inotrooppinen tuki ilmeni hyvin yleisenä interventiona perfuusion parantamiseksi ja sydämen tuotannon normalisoimiseksi LoHF-potilailla.
inotrooppinen lääkitys, kuten levosimendaani, dobutamiini, dopamiini, vasodilataattori (nitroprussidi) ja IABP paransivat merkitsevästi luottamusväliä lähtötilanteen ja hoidon jälkeen. Inotrooppisten aineiden osalta levosimendaani parantaa tehokkaammin hemodynaamista stabiilisuutta ja ehkäisee paremmin lyhytaikaista kuolemaa (30 päivän kuolleisuutta) kuin dobutamiini. Lisäksi inotroopit voivat toimia ennaltaehkäisevästi leikkauksen jälkeisen LoHF: n kehittymistä vastaan. Toisaalta, vaikka inotroopit parantavat hemodynaamista ja normalisoivat sydämen ulostuloa, ne eivät tarjoa mitään merkittävästi parempaa suojaa kuolleisuutta vastaan riippumatta käytetystä inotroopin tyypistä.
inotrooppisten aineiden roolia LoHF: n hoidossa on tukenut aiempi katsaus inotrooppisista aineista ja vasodilataattoristrategioista kardiogeenisen sokin ja LCOS: n hoidossa . Inotroopit parantavat katsauksessa hemodynamiikkaa, postoperatiivisten LCOS: ien haittatapahtumia ja vähentävät kuolleisuutta. Uudempi inotropes kuten levosimendan (kalsium herkistäjä ja inodilaattori) on positiivinen inotrooppi on joitakin vasodilatorisia ominaisuuksia . Sitä voidaan pitää myös selektiivisenä maksan vasodilataattorina, joka voi parantaa portaalilaskimovirtausta maksavaltimon ja portaalilaskimovirtauksen kautta verrattuna dobutamiiniin, joka voi vain parantaa portaalilaskimovirtausta vasodilatoimatta maksavaltimoa . Levosimendaani ei myöskään lisää sydänlihaksen hapenkulutusta, ja sitä suositellaan dobutamiinia enemmän lohf-potilaille, joilla on akuutti sydänlihasiskemia tai sydänleikkauksen jälkeen . Leikkauksen jälkeisessä LoHF: ssä inotrooppien suojaava vaikutus lyhytaikaista kuolleisuutta vastaan (30 päivän kuolleisuus) on edelleen merkityksetön lumelääkkeeseen verrattuna .
nykyisessä systemaattisessa katsauksessa ja meta-analyysissä on joitakin merkittäviä rajoituksia. LoHF: ää voi esiintyä toissijaisesti taustalla olevan sydänsairauden, kuten akuutin sydäninfarktin tai leikkauksen jälkeen. Useimmissa tutkimuksissa tutkittiin leikkauksen jälkeistä LoHF: ää, jossa LoHF: ää esiintyi vähemmän muista syistä. Suurin osa tutkimuksista keskittyi kahteen inotrooppiin (Levosimendaani ja dobutamiini) rajoittaen muiden inotrooppien sekä muiden hoitojen, kuten laitehoitojen, ymmärtämistä. Joissakin tutkimuksissa analyysissä oli vaarana luokitteluvirhe, joka johtui merkittävästä määrästä potilaita, jotka jäivät pois seurannasta. Koska useimmissa tutkimuksissa ei raportoida pareittain eroa ennen ja jälkeen intervention ja siihen liittyvän keskihajonnan, ennen ja jälkeen intervention ero keskihajonnan, ennen ja jälkeen intervention tulokset mittaavat riippumattomina, tämä saadaan sider luottamusvälit hoidon vaikutus liittyy keskihajonta.
johtopäätös
Low-output heart failure (LoHF) on kliininen oireyhtymä, jolle on ominaista sydämen tuotannon väheneminen ja end-elin hypoperfuusio. Se on melko harvinainen sydämen vajaatoiminnan muoto yleisväestössä, mutta yleinen leikkauksen jälkeisillä HF-potilailla. Sen etiologia on heterogeeninen, joka koostuu erilaisista tiloista, jotka aiheuttavat matalan tuotoksen tilan ja sydänkirurgian. Tärkeimmät patofysiologiset mekanismit ovat LV: n systolinen ja/tai diastolinen toimintahäiriö ja RV: n toimintahäiriö, joka johtuu sykkeen, esikuormituksen, jälkikuormituksen ja/tai supistuvuuden muutoksista. Lohf: n yleisiä riskitekijöitä ovat Chagasin tauti, alentunut ejektiofraktio ja munuaisten toimintahäiriö, kun taas leikkauksen jälkeisillä potilailla on heikentynyt LV-toiminta, epätäydellinen revaskularisaatio, vanhempi ikä ja diabetes ja munuaisten toimintahäiriö. Diagnoosista puuttuu standardoidut ohjeet ja se on riippuvainen hemodynaamisten ja fysiologisten poikkeamien hyväksytystä keräämisestä, mukaan lukien olosuhteet, jotka aiheuttavat alhaisen tuotoksen tilan. Potilaan historia ja fyysinen tutkimus auttavat arvioimaan hemodynaamista tilaa ja tunnistamaan matalan tuotoksen tilan, kun taas ekokardiografia vahvistaa kammion toimintahäiriön (Hf) ja alhaisen sydämen tuotoksen. Muita testejä tukemaan diagnoosin tai määrittää syy alhainen-output tila ovat elektrokardiogrammi ja perus laboratoriokokeet (veri, seerumin elektrolyytti, urea ja kreatiniini, maksa testi, kilpirauhasen toiminta ja seerumin natriureettiset peptidit) ja sydämen kuvantaminen (rintakehän röntgenkuvaus tai sepelvaltimoiden angiografia). Hoito-ohjeet puuttuvat, mutta sopivimman hoitostrategian valinta riippuu yksilöllisen patofysiologian arvioinnista. Hoito sisältää hengityskoneen strategioita parantaa sykettä ja rytmiä; äänenvoimakkuuden säätö optimoida esikuormitus; farmakologinen tuki (inotropes ja vasodilataattorit) manipuloida jälkikuormitus ja parantaa supistumiskykyä; ja laite hoito (intra-aortan ilmapallo pumppu tai kammion avustin laite), kun nämä strategiat eivät palauta sydämen tuotantoa. Valituilla potilailla, hoitoja kääntää perussairaus, voi palauttaa sydämen tuotantoa.
- Inamdar A, Inamdar A (2016) sydämen vajaatoiminnan diagnoosi, hoito ja käyttö. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) Recent developments in heart failure. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Kehitetty yhteistyössä ESC: n Heart Failure Associationin (HFA) kanssa. Eur J Heart Fail 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, et al. (2013) 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Euroopan kardiologian seuran (ESC) akuutin ja kroonisen sydämen vajaatoiminnan diagnosointia ja hoitoa käsittelevä työryhmä kehittyi ESC: n sydämen Vajaatoimintayhdistyksen (HFA) erityisrahoituksella. EUR Heart J 37: 2129-2200.
- Masse L, Antonacci M (2005) Low cardiac output syndrome: identification and management. Crit Care Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) kongestiivinen sydämen vajaatoiminta. Am J Respir Crit Care Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. EUR Heart J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) Cardiac performance and mortality early after intracardiac surgery in infants and young children. Levikki 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) postoperatiivinen kurssi ja hemodynaaminen profiili valtimokytkimen leikkauksen jälkeen vastasyntyneillä ja imeväisillä: vertailu matalan virtauksen kardiopulmonaalinen ohitusleikkaus ja verenkiertoelimistön pysähtyminen. Levikki 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) Cardiac and neurologic complications identify risks for mortality for both men and women in subconary coronary bypass transft surgery. Anaesthesiology 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) sepelvaltimon ohitusleikkauksen jälkeisen alhaisen sydämen ulostulon oireyhtymän ennustajat. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) Epidemiology and new predictors of low Heart output syndrome after isolated coronary oypass grafting. EUR Heart J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, et al. (2012) risk factors for low Heart output syndrome after coronary Authority bypass grafting surgery. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Predictors of low Heart output syndrome after isolated coronary coronary bypass surgery: trends over 20 years. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Management of the low Heart output syndrome following surgery for congenitional heart disease. Curr Cardiol Rev. 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) sydänleikkauksen jälkeinen matalan sydämen-ulostulon oireyhtymä. J Cardiothorac Vasc Anesth31: 291-308.
- Tibby SM., Murdoch IA (2003) Monitoring cardiac function in intensive care. Arch Tämä Lapsi 88: 46-52.
- Carcillo JA, Field AI (2002) Clinical practice parameters for hemodynamic support of pediatric and neonatal patients in septic shock. Crit Care Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) Cardiomyocyte death: mechanisms and translational implications. Solukuolema & tauti 2: e244.
- Tavernarakis N (2007) Kardiomyocyte necrosis: alternative mechanisms, effective interventions. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research 1773: 480-482.
- Dorn GW (2008) Apoptoottinen ja ei-apoptoottinen kardiomyosyyttikuolema kammiomuutoksessa. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) the tainnutettu ja hibernating myokardium: a brief review. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) diastolinen sydämen vajaatoiminta sydänleikkauksen jälkeen. In Coronary Coronary Disease-Current Concepts in Epidemiology, Patofysiology, Diagnostics and Treatment 2012. InTech.
- Kasss DA, Bronzwaer JG, Paulus WJ (2004) mitkä mekanismit ovat sydämen vajaatoiminnan diastolisen toimintahäiriön taustalla? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) Heart failure with preserved ejektiofraktio: patofysiology, diagnosis, and treatment. EUR Heart J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) onko Fosfolambaani tai troponiini I ”primadonna” β-adrenergisen indusoidun Lusitropian suhteen? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) Acute effects of typpic oxide on left ventrikular relaxation and diastolinen distensbility in humans. Arviointi bikoronaarisella natriumnitroprussidi-infuusiolla. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prevalence of Left Ventrikular Diastolic Filling Abnorrnalities in Adult Cardiac Surgical Patients: An Intraoperative Echo cardiographic Study. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) biventrikulaariset diastoliset täyttömallit sepelvaltimon ohitusleikkauksen jälkeen. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Pulmonary arterial hypertension: the key role of ekokardiography. Arkku 127: 1836-1843.
- Zochios V, Jones n (2014) akuutti oikean sydämen oireyhtymä kriittisesti sairaalla potilaalla. Sydänkeuhko 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Initial clinical experience with a miniaturized transesofageal ekokardiografia probe in a heart intensive care unit. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Performance of the right congestion under stress: Relation to right coronary flow. J Clin Invest 50: 2176-2183.
- Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Pulmonary vascular and right ventrikular dysfunction in adult critical care: Current and emerging options for management: a systematic literature review. Crit Care 14: R169.
- Pfisterer M (2003) oikean kammion osallistuminen sydäninfarktiin ja kardiogeeniseen sokkiin. Lancet 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Predictors of low Heart output in dekompensated severe heart failure. Klinikat 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Clinical outcome of urgent coronary coronary bypass grafting. J Korean Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Predictors of low Heart output syndrome after isolated aorttaläppäleikkaus. Levikki 112: I-448.
- Lomivorotov VV, Efremov SM, Boboško VA, Nikolajev DA, Vedernikov PE, et al. (2013) Evaluation of nutritional screening tools for patients scheduled for cardiac surgery. Ravinto 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) Hemoglobin and B-type natriuretic peptide preoperative values but not inflammatory markers, are associated with postoperative morbidity in heart surgery: a prospective cohort analytic study. J Cardiothorac Surg 8:170.
- Lomivorotov VV, Efremov SM, Boboško VA, Leyderman IN, Lomivorotov VN, et al. (2011) perifeerisen veren preoperatiivinen kokonaislymposyyttimäärä heikon hoitotuloksen ennustajana aikuisten sydänkirurgiassa. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) n-terminal pro-B-type natriuretic peptide levels and early outcome after heart surgery: a prospective cohort study. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Utility of B-type natriuretic peptide in predicting postoperative complications and outcomes in patients in heart surgery. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) Relationship between accession serum sodium concentration and clinical outcomes in patients hospitalized for heart failure: an analysis from the OPTIMIZE-HF registry. EUR Heart J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) in-hospital mortality in patients with acute dekompensated heart failure requiring intravenous vasoactive medications: an analysis from the Acute Dekompensated Heart Failure National Registry (accept). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Team management of patients with heart failure: a statement for healthcare professionals from the Cardiovascular Nursing Council of the American Heart Association. Levikki 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) The limited reliability of physical signs for estimating hemodynamics in chronic heart failure. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) Clinical assessment identifies hemodynaamiset profiilit, jotka ennustavat tuloksia potilailla, joille on otettu sydämen vajaatoiminta. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) akuutin sydäninfarktin Medical therapy by application of hemodynamic subsets. Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) Medical management of advanced heart failure. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) Echocardiography in heart failure: applications, utility, and new horizons. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) ekokardiographic evaluation of hemodynamics in patients with dekompensated systolinen heart failure. Circ Cardiovasc Imaging 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) Recommendations for cardiac chamber quantification by echokardiografia in adults: an update from the American Society of echokardiografia and the European Association of Cardiovascular Imaging. EUR Heart J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) appropriate criteria for cardiovascular imaging use in heart failure: report of literature review. EUR Heart J Cardiovasc Imaging 16: 147-153.
- gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) non-invasiivinen cardiac imaging evaluation of patients with chronic systolinen heart failure: a report from the European Association of Cardiovascular Imaging (EACVI). EUR Heart J 35: 3417-3425.
- Vazir a, Cowie MR (2012) Assessing acute dekompensated heart failure: Strategies and tools. Cardiol 8 Euroa: 128-133.
- Gray A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) noninvasive ventilation in acute cardiogenic keuhkopöhö. 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) hemodynaaminen seuranta akuutissa sydämen vajaatoiminnassa. Crit Care Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) the intra-aortan ilmapallo pump in heart failure management: implications for nursing practice. Aust Crit Care 22: 125-131.
- Slaughter MS, Singh R (2012) the role of ventrikular assist devices in advanced heart failure. Revista Española de Cardiologia 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) hemodynaamiset profiles of advanced heart failure: association with clinical characteristics and long-term outcomes. J – Kortti Hylätty 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) dobutamiinin paremmuus dopamiiniin nähden sydämen tuotannon lisäämiseksi potilailla, joilla on krooninen matalan tuotoksen sydämen vajaatoiminta. Levikki 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz h, et al. (2002) Levosimendaanin teho ja turvallisuus verrattuna dobutamiiniin vaikeassa low-output heart failure (the Lido study): a randomized double-blind trial. The Lancet 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) Low-output, low-gradientti aorttastenoosi potilailla, joilla on masentunut vasemman kammion systolinen toiminta: dobutamiinihaasteen kliininen hyöty katetrointilaboratoriossa. Levikki 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Effects of levosimendan versus dobutamine on inflammatory and apoptotic pathways in acutely dekompensated chronic heart failure. Am J Cardiol 98: 102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal a, Kleber FX, et al. (2007) Survive Investigators. Levosimendaani vs dobutamiini akuuttia dekompensoitua sydämen vajaatoimintaa sairastavilla potilailla: the SURVIVE Randomized Trial. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) kalsiumherkistäjä levosimendaani antaa paremmat tulokset dobutamiinille leikkauksen jälkeisessä alhaisen sydämen ulostulon oireyhtymässä. Revista Española de Cardiología (englanninkielinen painos) 61: 471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) Sodium nitroprusside for advanced low-output heart failure. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboško VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendaani vs. aortan sisäinen pallopumppu korkean riskin sydänpotilailla. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas s, Otero P, Rial M, et al. (2013) a comparison of doubutamine and levosimendan n heppal blood flow in patients with a low Heart output state after heart surgery: a randomised controlled study. Anaesth Intensive Care 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Effect of levosimendan on low cardiac output syndrome in patients with low ejektiofraktio Underground coronary bypass grafting with cardiopulmonal bypass: the LICORN randomized clinical trial. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendaani hemodynaamiseen tukeen sydänleikkauksen jälkeen. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen s, Meza J, Wang A, et al. (2017) levosimendaani potilailla, joilla on vasemman kammion toimintahäiriö sydänleikkauksessa. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche s, et al. (2018) inotrooppiset aineet ja vasodilataattoristrategiat kardiogeenisen sokin tai alhaisen sydämen ulostulon oireyhtymän hoitoon. Cochranen Kirjasto. 2 : 1-10.