8.3 : Moment Dipolaire Magnétique Orbital de l’Électron
Objectifs d’apprentissage
À la fin de cette section, vous pourrez ::
- Expliquer pourquoi l’atome d’hydrogène a des propriétés magnétiques
- Expliquer pourquoi les niveaux d’énergie d’un atome d’hydrogène associé au moment angulaire orbital sont divisés par un champ magnétique externe
- Utiliser des nombres quantiques pour calculer l’amplitude et la direction du moment dipolaire magnétique orbital d’un atome d’hydrogène
Dans le modèle de Bohr de l’atome d’hydrogène, l’électron se déplace sur une orbite circulaire autour du proton. L’électron passe par un point particulier de la boucle dans un certain temps, nous pouvons donc calculer un courant \ (I = Q /t\). Un électron qui orbite autour d’un proton dans un atome d’hydrogène est donc analogue au courant circulant à travers un fil circulaire (Figure\(\PageIndex{1}\)). Dans l’étude du magnétisme, nous avons vu qu’un fil porteur de courant produit des champs magnétiques. Il est donc raisonnable de conclure que l’atome d’hydrogène produit un champ magnétique et interagit avec d’autres champs magnétiques.
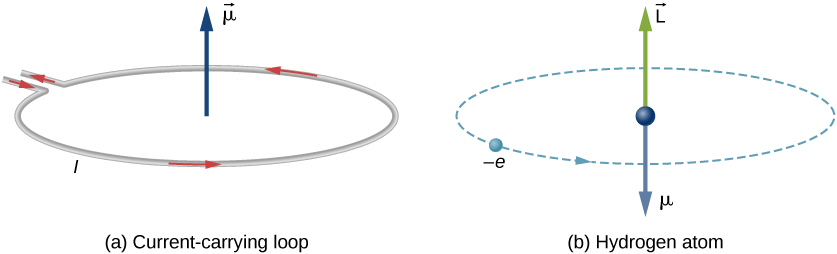
Le moment dipolaire magnétique orbital est une mesure de l’intensité du champ magnétique produit par le moment angulaire orbital d’un électron. À partir de la Force et du Couple sur une boucle de courant, l’amplitude du moment dipolaire magnétique orbital pour une boucle de courant est
\
où \(I\) est le courant et \(A\) est l’aire de la boucle. (Pour plus de concision, nous appelons cela le moment magnétique.) Le courant \(I\) associé à un électron en orbite autour d’un proton dans un atome d’hydrogène est
\
où e est l’amplitude de la charge de l’électron et \(T\) est sa période orbitale. Si l’on suppose que l’électron se déplace sur une orbite parfaitement circulaire, la période orbitale est
\
où r est le rayon de l’orbite et v est la vitesse de l’électron sur son orbite. Étant donné que l’aire d’un cercle est \(\pi r ^2\), le moment magnétique absolu est
\
Il est utile d’exprimer le moment magnétique μμ en termes de moment angulaire orbital (\(\vec{L} = \vec{r}\times\vec{p}\)). Parce que l’électron orbite dans un cercle, le vecteur position \(\vec{r}\) et le vecteur moment \(\vec{p}\) forment un angle droit. Ainsi, l’amplitude du moment angulaire orbital est
\
En combinant ces deux équations, on a
\
Sous forme vectorielle complète, cette expression s’écrit comme
\
Le signe négatif apparaît car l’électron a une charge négative. Notez que la direction du moment magnétique de l’électron est antiparallèle au moment angulaire orbital, comme le montre la figure \(\PageIndex{1b}\). Dans le modèle de Bohr de l’atome, la relation entre \(\vec{\mu}\) et \(\vec{L}\) dans l’équation \ref{BIG} est indépendante du rayon de l’orbite.
Le moment magnétique \(μ\) peut également être exprimé en termes de nombre quantique angulaire orbital \(l\). En combinant l’équation \ref{eq2} et l’équation \ref{eq1}, l’amplitude du moment magnétique est
\
La composante z du moment magnétique est
\&=-\left(\dfrac{e}{2m_e}\right)\, m\hbar\\&=-\mu_B m.\label {eq6}\end{align}\]
La quantité \(\mu_B\) est une unité fondamentale du magnétisme appelée magnéton de Bohr, qui a la valeur \(9,3\fois 10^{-24}\, Joule/Tesla\) (J/T) ou \(5,8\fois 10^{-5} eV/T\). La quantification du moment magnétique est le résultat de la quantification du moment angulaire orbital.
Comme nous le verrons dans la section suivante, le moment dipolaire magnétique total de l’atome d’hydrogène est dû à la fois au mouvement orbital de l’électron et à son spin intrinsèque. Pour l’instant, nous ignorons l’effet du spin électronique.
Exemple \(\PageIndex{1}\): Moment dipolaire magnétique orbital
Quelle est la magnitude du moment magnétique dipolaire orbital μ d’un électron dans l’atome d’hydrogène dans l’état (a) s, (b)p et (c)d? (Supposons que le spin de l’électron soit nul.)
Stratégie
Le moment magnétique de l’électron est lié à son moment angulaire orbital L. Pour l’atome d’hydrogène, cette quantité est liée au nombre quantique angulaire orbital l. Les états sont donnés en notation spectroscopique, qui rapporte une lettre (s, p, d, etc.) à un nombre quantique.
Solution
La magnitude du moment magnétique est donnée dans l’équation \ref{eq5}:
\&= \left(\dfrac{e}{2m_e}\right)\, \sqrt{l(l+1)} \hbar\nonumber\\&=\mu_B\sqrt {l(l+1)}. \end{align}\]
- Pour l’état s, \(l = 0\) nous avons donc \(\mu= 0\) et \(\mu_z= 0\).
- Pour l’état p, \(l = 0\) et nous avons \\where\(m = (-1, 0, 1)\) donc \
- Pour l’état d, \(l = 2\) et nous obtenons \\where\(m = (-2, -1, 0, 1, 2)\) donc \
Signification
Dans l’état s, il n’y a pas de moment angulaire orbital et donc pas de moment magnétique. Cela ne signifie pas que l’électron est au repos, mais simplement que le mouvement global de l’électron ne produit pas de champ magnétique. Dans l’état p, l’électron a un moment magnétique avec trois valeurs possibles pour la composante z de ce moment magnétique; cela signifie que le moment magnétique peut pointer dans trois directions polaires différentes – chaque antiparallèle au vecteur de moment angulaire orbital. Dans l’état d, l’électron a un moment magnétique avec cinq valeurs possibles pour la composante z de ce moment magnétique. Dans ce cas, le moment magnétique peut pointer dans cinq directions polaires différentes.
Un atome d’hydrogène a un champ magnétique, nous nous attendons donc à ce que l’atome d’hydrogène interagisse avec un champ magnétique externe — tel que la poussée et la traction entre deux aimants à barres. D’après la Force et le Couple sur une boucle de courant, nous savons que lorsqu’une boucle de courant interagit avec un champ magnétique externe \(\vec{B}\), elle subit un couple donné par
\
où I est le courant, \(\vec{A}\) est l’aire de la boucle, \(\vec{\mu}\) est le moment magnétique et \(\vec{B}\) est le champ magnétique externe. Ce couple agit pour faire tourner le vecteur de moment magnétique de l’atome d’hydrogène pour l’aligner sur le champ magnétique externe. Parce que le travail mécanique est effectué par le champ magnétique externe sur l’atome d’hydrogène, on peut parler de transformations énergétiques dans l’atome. L’énergie potentielle de l’atome d’hydrogène associé à cette interaction magnétique est donnée par l’équation \ref{eq30} :
\
Si le moment magnétique est antiparallèle au champ magnétique externe, l’énergie potentielle est grande, mais si le moment magnétique est parallèle au champ, l’énergie potentielle est faible. Le travail effectué sur l’atome d’hydrogène pour faire tourner le vecteur de moment magnétique de l’atome dans la direction du champ magnétique externe est donc associé à une baisse d’énergie potentielle. L’énergie du système est cependant conservée car une baisse d’énergie potentielle produit un rayonnement (l’émission d’un photon). Ces transitions d’énergie sont quantifiées car le moment magnétique ne peut pointer que dans certaines directions.
Si le champ magnétique externe pointe dans la direction z positive, l’énergie potentielle associée au moment dipolaire magnétique orbital est
\
où \(\mu_B\) est le magnéton de Bohr et m est le nombre quantique de projection de moment angulaire (ou nombre quantique orbital magnétique), qui a les valeurs
\
Par exemple, à l’état d’électron \(l = 1\), l’énergie totale de l’électron est divisée en trois niveaux d’énergie distincts correspondant à \(U = -\mu_B B, 0, \mu_B B\).
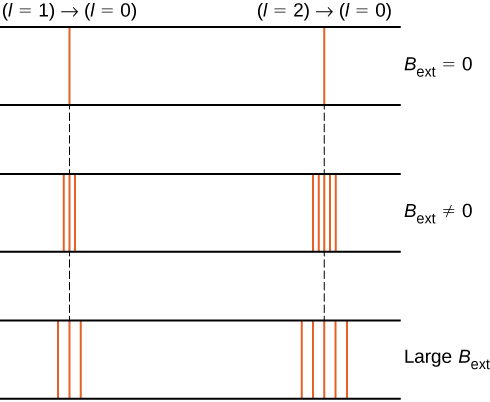
La division des niveaux d’énergie par un champ magnétique externe est appelée effet Zeeman. En ignorant les effets du spin électronique, les transitions de l’état \(l = 1\) à un état commun d’énergie inférieure produisent trois raies spectrales étroitement espacées (Figure \(\PageIndex{2}\), colonne de gauche). De même, les transitions de l’état \(l = 2\) produisent cinq raies spectrales étroitement espacées (colonne de droite). La séparation de ces lignes est proportionnelle à l’intensité du champ magnétique externe. Cet effet a de nombreuses applications. Par exemple, la division des raies dans le spectre de l’hydrogène du Soleil est utilisée pour déterminer la force du champ magnétique du Soleil. Beaucoup de ces mesures de champ magnétique peuvent être utilisées pour faire une carte de l’activité magnétique à la surface du Soleil appelée magnétogramme (Figure \(\PageIndex{3}\)).

Contributeurs et attributions
Samuel J. Ling (Université d’État de Truman), Jeff Sanny (Université Loyola Marymount) et Bill Moebs avec de nombreux auteurs contributeurs. Ce travail est concédé sous licence par OpenStax University Physics sous licence Creative Commons Attribution (by 4.0).