8.3: Momento Dipolar Magnético Orbital del Electrón
Objetivos de aprendizaje
Al final de esta sección, podrá::
- Explicar por qué el átomo de hidrógeno tiene propiedades magnéticas
- Explicar por qué los niveles de energía de un átomo de hidrógeno asociados con el momento angular orbital se dividen por un campo magnético externo
- Utilizar números cuánticos para calcular la magnitud y dirección del momento dipolar magnético orbital de un átomo de hidrógeno
En el modelo de Bohr del átomo de hidrógeno, el electrón se mueve en una órbita circular alrededor del protón. El electrón pasa por un punto particular en el bucle en un tiempo determinado, por lo que podemos calcular una corriente \(I = Q/t\). Un electrón que orbita un protón en un átomo de hidrógeno es, por lo tanto, análogo a la corriente que fluye a través de un alambre circular (Figura \(\pageIndex{1}\)). En el estudio del magnetismo, vimos que un cable portador de corriente produce campos magnéticos. Por lo tanto, es razonable concluir que el átomo de hidrógeno produce un campo magnético e interactúa con otros campos magnéticos.
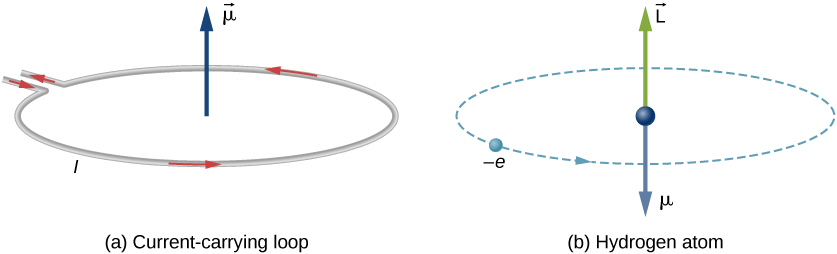
El momento dipolar magnético orbital es una medida de la fuerza del campo magnético producido por el momento angular orbital de un electrón. A partir de la Fuerza y el Par en un Bucle de Corriente, la magnitud del momento dipolar magnético orbital para un bucle de corriente es
\
donde \(I\) es la corriente y\ (A\) es el área del bucle. (Para brevedad, nos referimos a esto como el momento magnético.) La corriente \(I\) asociada con un electrón en órbita alrededor de un protón en un átomo de hidrógeno es
\
donde e es la magnitud de la carga del electrón y \(T\) es su período orbital. Si asumimos que el electrón viaja en una órbita perfectamente circular, el período orbital es
\
donde r es el radio de la órbita y v es la velocidad del electrón en su órbita. Dado que el área de un círculo es \(\pi r^2\), el momento magnético absoluto es
\
Es útil expresar el momento magnético μμ en términos del momento angular orbital (\(\vec{L} = \vec{r} \times \vec{p}\)). Debido a que el electrón orbita en un círculo, el vector de posición \(\vec{r}\) y el vector de momento \(\vec{p}\) forman un ángulo recto. Por lo tanto, la magnitud del momento angular orbital es
\
Combinando estas dos ecuaciones, tenemos
\
En forma vectorial completa, esta expresión se escribe como
\
El signo negativo aparece porque el electrón tiene una carga negativa. Observe que la dirección del momento magnético del electrón es antiparalela al momento angular orbital, como se muestra en la Figura \(\pageIndex{1b}\). En el modelo de Bohr del átomo, la relación entre \(\vec {\mu}\) y \(\vec{L}\) en la ecuación \ref{BIG} es independiente del radio de la órbita.
El momento magnético \ (μ\) también se puede expresar en términos del número cuántico angular orbital \(l\). Combinando la ecuación \ref{eq2} y la ecuación \ref{eq1}, la magnitud del momento magnético es
\
El componente z del momento magnético es
\ &=-\left(\dfrac{e}{2m_e}\right) \, m \hbar \\ &= – \mu_B m. \label{eq6} \end{align}\]
La cantidad \(\mu_B\) es una unidad fundamental de magnetismo llamada magnetón Bohr, que tiene el valor \(9.3 \times 10^{-24} \, Joule/Tesla\) (J/T) o \(5.8 \times 10^{-5} eV/T\). La cuantización del momento magnético es el resultado de la cuantización del momento angular orbital.
Como veremos en la siguiente sección, el momento dipolar magnético total del átomo de hidrógeno se debe tanto al movimiento orbital del electrón como a su espín intrínseco. Por ahora, ignoramos el efecto del espín de electrones.
Ejemplo \(\pageIndex{1}\): Momento Dipolar Magnético Orbital
¿Cuál es la magnitud del momento magnético dipolar orbital μ de un electrón en el átomo de hidrógeno en el estado (a) s, (b) p y (c) d? (Supongamos que el espín del electrón es cero.)
Estrategia
El momento magnético del electrón está relacionado con su momento angular orbital L. Para el átomo de hidrógeno, esta cantidad está relacionada con el número cuántico angular orbital l. Los estados se dan en notación espectroscópica, que relaciona una letra (s, p, d, etc.) a un número cuántico.
Solución
La magnitud del momento magnético está dada en la Ecuación \ref{eq5}:
\ &= \left(\dfrac{e}{2m_e}\derecho) \, \sqrt{l(l + 1)} \manejadores \nonumber \\ &= \mu_B\sqrt{l(l + 1)}. \end{align}\]
- Para el estado s, \(l = 0\) por lo que tenemos \(\mu = 0\) y \(\mu_z = 0\).
- Para el p estado, \(l = 0\) y hemos \ \ donde \(m = (-1, 0, 1)\) así \
- Para el estado d, \(l = 2\) y obtenemos \ \ donde \(m = (-2, -1, 0, 1, 2)\) así \
Importancia
En el estado s, no es el impulso angular orbital y por lo tanto ningún momento magnético. Esto no significa que el electrón esté en reposo, solo que el movimiento general del electrón no produce un campo magnético. En el estado p, el electrón tiene un momento magnético con tres valores posibles para el componente z de este momento magnético; esto significa que el momento magnético puede apuntar en tres direcciones polares diferentes, cada antiparalelo al vector de momento angular orbital. En el estado d, el electrón tiene un momento magnético con cinco valores posibles para el componente z de este momento magnético. En este caso, el momento magnético puede apuntar en cinco direcciones polares diferentes.
Un átomo de hidrógeno tiene un campo magnético, por lo que esperamos que el átomo de hidrógeno interactúe con un campo magnético externo, como el empuje y el tirón entre dos barras magnéticas. Por Fuerza y Par en un Bucle de Corriente, sabemos que cuando un bucle de corriente interactúa con un campo magnético externo \(\vec{B}\), experimenta un par dado por
\
donde I es la corriente, \(\vec{A}\) es el área del bucle, \(\vec{\mu}\) es el momento magnético, y \(\vec{B}\) es el campo magnético externo. Este par actúa para rotar el vector de momento magnético del átomo de hidrógeno para alinearse con el campo magnético externo. Debido a que el trabajo mecánico es realizado por el campo magnético externo en el átomo de hidrógeno, podemos hablar de transformaciones de energía en el átomo. La energía potencial del átomo de hidrógeno asociado con esta interacción magnética está dada por la Ecuación \ref{eq30}:
\
Si el momento magnético es antiparalelo al campo magnético externo, la energía potencial es grande, pero si el momento magnético es paralelo al campo, la energía potencial es pequeño. Por lo tanto, el trabajo realizado en el átomo de hidrógeno para rotar el vector de momento magnético del átomo en la dirección del campo magnético externo se asocia con una caída en la energía potencial. La energía del sistema se conserva, sin embargo, porque una caída en la energía potencial produce radiación (la emisión de un fotón). Estas transiciones de energía están cuantizadas porque el momento magnético solo puede apuntar en ciertas direcciones.
Si el campo magnético externo apunta en la dirección z positiva, la energía potencial asociada con el momento dipolar magnético orbital es
\
donde \(\mu_B\) es el magnetón de Bohr y m es el número cuántico de proyección de momento angular (o número cuántico orbital magnético), que tiene los valores
\
Por ejemplo, en el estado \(l = 1\) de electrones, la energía total del electrón se divide en tres niveles de energía distintos correspondiente a \(U = -\mu_B B, 0, \mu_B B\).
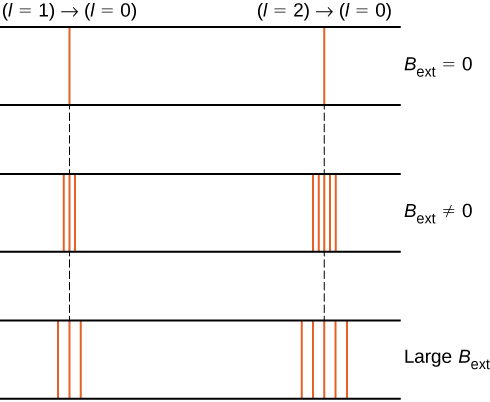
La división de los niveles de energía por un campo magnético externo se denomina efecto Zeeman. Ignorando los efectos del espín de electrones, las transiciones del estado \(l = 1\) a un estado común de energía inferior producen tres líneas espectrales muy espaciadas (Figura \(\pageIndex{2}\), columna izquierda). Del mismo modo, las transiciones desde el estado \(l = 2\) producen cinco líneas espectrales muy espaciadas (columna derecha). La separación de estas líneas es proporcional a la fuerza del campo magnético externo. Este efecto tiene muchas aplicaciones. Por ejemplo, la división de líneas en el espectro de hidrógeno del Sol se utiliza para determinar la fuerza del campo magnético del Sol. Muchas de estas mediciones de campo magnético se pueden usar para hacer un mapa de la actividad magnética en la superficie del Sol llamado magnetograma (Figura \(\pageIndex{3}\)).

Colaboradores y atribuciones
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) y Bill Moebs con muchos autores colaboradores. Este trabajo está licenciado por OpenStax University Physics bajo una Licencia de Atribución Creative Commons (by 4.0).