8.3: az elektron orbitális mágneses dipólus pillanata
tanulási célok
e szakasz végére képes lesz arra, hogy:
- magyarázza el, hogy a hidrogénatom miért rendelkezik mágneses tulajdonságokkal
- magyarázza el, hogy egy hidrogénatom energiaszintjét az orbitális szögmomentumhoz egy külső mágneses mező osztja meg
- kvantumszámokkal számolja ki a hidrogénatom orbitális mágneses dipólus momentumának nagyságát és irányát
Bohr hidrogénatom-modelljében az elektron körkörös pályán mozog a proton körül. Az elektron egy bizonyos idő alatt áthalad a hurok egy adott pontján, így kiszámolhatunk egy \(I = Q/t\) áramot. Egy elektron, amely egy proton körül kering egy hidrogénatomban, ezért analóg a kör alakú huzalon átáramló árammal (\(\PageIndex{1}\) ábra). A mágnesesség tanulmányozása során láttuk, hogy egy áramvezető huzal mágneses mezőket hoz létre. Ezért ésszerű azt a következtetést levonni, hogy a hidrogénatom mágneses mezőt hoz létre és kölcsönhatásba lép más mágneses mezőkkel.
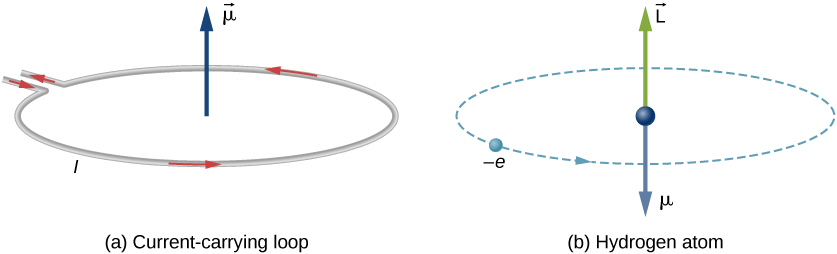
az orbitális mágneses dipólus Momentum az elektron orbitális szögimpulzusa által előállított mágneses mező erősségének mértéke. Az erő és a nyomaték egy Áramhurokon, az orbitális mágneses dipólus Momentum nagysága egy áramhuroknál
\
ahol \(i\) az áram és \(a\) a hurok területe. (A rövidség kedvéért ezt mágneses pillanatnak nevezzük.) A hidrogénatomban egy proton körül keringő elektronhoz társított \(I\) áram
\
ahol e az elektrontöltés nagysága, \(T\) pedig az orbitális periódusa. Ha feltételezzük, hogy az elektron tökéletesen kör alakú pályán halad, akkor az orbitális periódus
\
ahol r A pálya sugara, v pedig az elektron sebessége a pályáján. Tekintettel arra, hogy egy kör területe \(\pi r^2\), az abszolút mágneses momentum
\
hasznos a mágneses momentum kifejezése az orbitális szögimpulzus szempontjából (\(\vec{l} = \vec{r} \times \vec{p}\)). Mivel az elektron egy körben kering, a pozícióvektor \(\vec{r}\) és a lendület vektor \(\vec{p}\) derékszöget képez. Így az orbitális szögimpulzus nagysága
\
e két egyenlet kombinálásával
\
teljes vektor formában van, ezt a kifejezést
\
a negatív jel azért jelenik meg, mert az elektron negatív töltéssel rendelkezik. Figyeljük meg, hogy az elektron mágneses momentumának iránya párhuzamos az orbitális szögimpulzussal, amint azt a \(\PageIndex{1b}\) ábra mutatja. Az atom Bohr-modelljében a \(\vec{\mu}\) és \(\vec{L}\) közötti kapcsolat a \ref{BIG} egyenletben független a pálya sugarától.
a mágneses momentum \(\) kifejezhető a \(L\) orbitális szögkvantumszámmal is. A \ref{eq2} egyenlet és a \ref{EQ1} egyenlet kombinálásával a mágneses momentum nagysága
\
a mágneses momentum z-komponense
\ &= – \left(\dfrac{e}{2m_e}\right)\, m \hbar \\ &= – \mu_b m. \label{EQ6} \end{align}\]
a \(\mu_b\) mennyiség a Bohr magnetonnak nevezett mágnesesség alapvető egysége, amelynek értéke \(9,3 \szorozva 10^{-24}\, Joule/Tesla\) (j/t) vagy \(5,8 \szorozva 10^{-5} EV/t\). A mágneses pillanat kvantálása az orbitális szögimpulzus kvantálásának eredménye.
mint a következő szakaszban látni fogjuk, a hidrogénatom teljes mágneses dipólus momentuma mind az elektron orbitális mozgásának, mind annak belső spinjének köszönhető. Egyelőre figyelmen kívül hagyjuk az elektron spin hatását.
példa \(\PageIndex{1}\): orbitális mágneses dipólus Momentum
mekkora a hidrogénatomban lévő elektron orbitális dipólus mágneses momentumának nagysága (a) S, (b) p és (c) d állapotban? (Tegyük fel, hogy az elektron spinje nulla.)
stratégia
az elektron mágneses lendülete az orbitális szögmomentumához kapcsolódik L. a hidrogénatom esetében ez a mennyiség az orbitális szögkvantumszámhoz kapcsolódik l. az állapotokat spektroszkópiai jelölésben adjuk meg, amely egy betűt (s, p, d stb.) kvantumszámra.
megoldás
a mágneses momentum nagyságát a \ref{eq5} egyenlet adja meg:
\ &= \left(\dfrac{e}{2m_e}\right) \, \sqrt{l(l + 1)} \hbar \nonumber \\ &= \mu_b\sqrt{l(l + 1)}. \ end{align}\]
- az s állapotra, \(l = 0\) tehát van \(\mu = 0\) és \(\mu_z = 0\).
- A p állapot, \(l = 0\) és van \ \ ahol \(m = (-1, 0, 1)\) tehát \
- A d állapotra, \(l = 2\) és megkapjuk \ \ where \(m = (-2, -1, 0, 1, 2)\) Tehát \
jelentőség
s állapotban nincs orbitális szögimpulzus, ezért nincs mágneses pillanat. Ez nem azt jelenti, hogy az elektron nyugalomban van, csak azt, hogy az elektron általános mozgása nem hoz létre mágneses mezőt. P állapotban az elektronnak van egy mágneses momentuma, amelynek három lehetséges értéke van ennek a mágneses momentumnak a z-komponensére; ez azt jelenti, hogy a mágneses momentum három különböző poláris irányba mutathat—mindegyik antiparallel az orbitális szögimpulzus vektorhoz. D állapotban az elektronnak van egy mágneses momentuma, amelynek öt lehetséges értéke van ennek a mágneses momentumnak a z-komponenséhez. Ebben az esetben a mágneses pillanat öt különböző poláris irányba mutathat.
a hidrogénatomnak mágneses mezője van, ezért elvárjuk, hogy a hidrogénatom kölcsönhatásba lépjen egy külső mágneses mezővel—például két rúdmágnes közötti nyomással és húzással. Az Áramhurok erőtől és Nyomatékától tudjuk, hogy amikor egy áramhurok kölcsönhatásba lép egy külső mágneses mezővel \(\vec{B}\), akkor a
\
által adott nyomatékot tapasztalja, ahol I az áram, \(\vec{a}\) a hurok területe, \(\vec {\mu}\) a mágneses pillanat, és \(\vec{B}\) a külső mágneses mező. Ez a nyomaték a hidrogénatom mágneses momentumvektorának elforgatására szolgál, hogy igazodjon a külső mágneses mezőhöz. Mivel a mechanikai munkát a hidrogénatom külső mágneses mezője végzi, beszélhetünk az atom energiaátalakulásáról. A mágneses kölcsönhatáshoz kapcsolódó hidrogénatom potenciális energiáját a \ref{eq30} egyenlet adja meg:
\
Ha a mágneses momentum párhuzamos a külső mágneses mezővel, akkor a potenciális energia nagy, de ha a mágneses momentum párhuzamos a mezővel, akkor a potenciális energia kicsi. A hidrogénatomon végzett munka az atom mágneses momentumvektorának a külső mágneses mező irányába történő elforgatására ezért a potenciális energia csökkenésével jár. A rendszer energiája azonban megmarad, mert a potenciális energia csökkenése sugárzást (foton kibocsátást) eredményez. Ezeket az energiaátmeneteket kvantáljuk, mert a mágneses pillanat csak bizonyos irányokba mutathat.
Ha a külső mágneses mező pozitív z irányba mutat, akkor az orbitális mágneses dipólus momentumhoz kapcsolódó potenciális energia
\
ahol \(\mu_B\) a Bohr magneton és m a szögimpulzus vetület kvantumszáma (vagy mágneses orbitális kvantumszám), amelynek értékei
\
például \(l = 1\) elektron állapotban az elektron teljes energiája három különálló energiaszintre oszlik megfelelő \(u = -\mu_b B, 0, \mu_b B\).
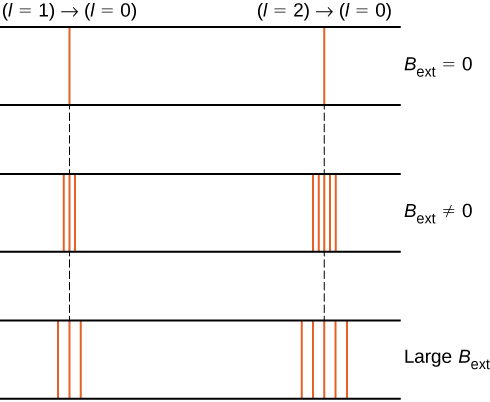
az energiaszintek külső mágneses tér általi felosztását Zeeman-effektusnak nevezzük. Figyelmen kívül hagyva az elektron spin hatásait, a \(l = 1\) állapotból a közös alacsonyabb energiájú állapotba való átmenet három szorosan elhelyezkedő spektrális vonalat eredményez (\(\PageIndex{2}\) ábra, bal oszlop). Hasonlóképpen, a \(l = 2\) állapotból történő átmenetek öt szorosan elhelyezkedő spektrális vonalat eredményeznek (jobb oldali oszlop). Ezeknek a vonalaknak a szétválasztása arányos a külső mágneses mező erejével. Ennek a hatásnak számos alkalmazása van. Például a nap hidrogénspektrumában lévő vonalak felosztását használják a Nap mágneses mezőjének erősségének meghatározására. Számos ilyen mágneses térmérés felhasználható a Nap felszínén lévő mágneses aktivitás térképének elkészítésére, amelyet magnetogramnak neveznek (\(\PageIndex{3}\) ábra).

közreműködők és attribútumok
Samuel J. Ling (Truman Állami Egyetem), Jeff Sanny (Loyola Marymount Egyetem) és Bill Moebs számos közreműködő szerzővel. Ez a munka által engedélyezett OpenStax University Physics alatt Creative Commons Nevezd Licenc (által 4.0).