Introductory Chemistry – 1st Canadian Edition
Lernziele
- Definieren Sie den Dampfdruck von Flüssigkeiten.
- Erklären Sie den Ursprung sowohl der Oberflächenspannung als auch der Kapillarwirkung.
Es gibt einige Eigenschaften, die alle Flüssigkeiten haben. Die Flüssigkeit, mit der wir am besten vertraut sind, ist wahrscheinlich Wasser und hat diese Eigenschaften. Andere Flüssigkeiten haben sie auch, was zu beachten ist.
Alle Flüssigkeiten haben einen bestimmten Teil ihrer Partikel, der genug Energie hat, um in die Gasphase einzutreten, und wenn sich diese Partikel an der Oberfläche der Flüssigkeit befinden, tun sie dies (Abbildung 10.6 „Verdampfung“). Die Bildung eines Gases aus einer Flüssigkeit bei Temperaturen unterhalb des Siedepunkts wird als Verdampfung bezeichnet. Bei diesen Temperaturen wird das Material in der Gasphase eher als Dampf als als Gas bezeichnet; Der Begriff Gas ist reserviert, wenn die Gasphase die stabile Phase ist.
Abbildung 10.6 Verdampfung

Einige Partikel einer Flüssigkeit haben genug Energie, um der flüssigen Phase zu entweichen und zu einem Dampf zu werden.
Wenn das verfügbare Volumen groß genug ist, wird die gesamte Flüssigkeit schließlich zu Dampf. Wenn das verfügbare Volumen jedoch nicht ausreicht, treten einige der Dampfpartikel schließlich wieder in die flüssige Phase ein (Abbildung 10.7 „Gleichgewicht“). Irgendwann entspricht die Anzahl der Partikel, die in die Dampfphase eintreten, der Anzahl der Partikel, die die Dampfphase verlassen, so dass sich die Dampfmenge im System netto nicht ändert. Wir sagen, dass das System im Gleichgewicht ist. Der Partialdruck des Dampfes im Gleichgewicht wird als Dampfdruck der Flüssigkeit bezeichnet.
Abbildung 10.7 Gleichgewicht

Irgendwann wird die Anzahl der Partikel, die in die Dampfphase eintreten, durch die Anzahl der Partikel ausgeglichen, die in die Flüssigkeit zurückkehren. Dieser Punkt wird Gleichgewicht genannt.
Verstehen Sie, dass die Flüssigkeit nicht aufgehört hat zu verdampfen. Der umgekehrte Prozess — die Kondensation – erfolgt so schnell wie die Verdampfung, so dass sich die Dampfmenge im System netto nicht ändert. Der Begriff dynamisches Gleichgewicht stellt eine Situation dar, in der ein Prozess noch auftritt, aber der entgegengesetzte Prozess tritt auch mit der gleichen Geschwindigkeit auf, so dass es keine Nettoänderung im System gibt.
Der Dampfdruck eines Stoffes ist abhängig von der Temperatur des Stoffes; mit steigender Temperatur steigt auch der Dampfdruck. Abbildung 10.8 „Diagramme von Dampfdruck gegen Temperatur für mehrere Flüssigkeiten“ ist ein Diagramm von Dampfdruck gegen Temperatur für mehrere Flüssigkeiten. Nachdem wir den Dampfdruck definiert haben, können wir auch den Siedepunkt einer Flüssigkeit neu definieren: die Temperatur, bei der der Dampfdruck einer Flüssigkeit dem Umgebungsdruck entspricht. Der normale Dampfdruck ist also die Temperatur, bei der der Dampfdruck 760 torr oder genau 1 atm beträgt. Daher variieren die Siedepunkte mit dem Umgebungsdruck, Eine Tatsache, die große Auswirkungen auf das Kochen von Lebensmitteln bei niedrigeren oder höheren als normalen Höhen haben kann. Der atmosphärische Druck variiert erheblich mit der Höhe.
Abbildung 10.8 Diagramme von Dampfdruck und Temperatur für mehrere Flüssigkeiten
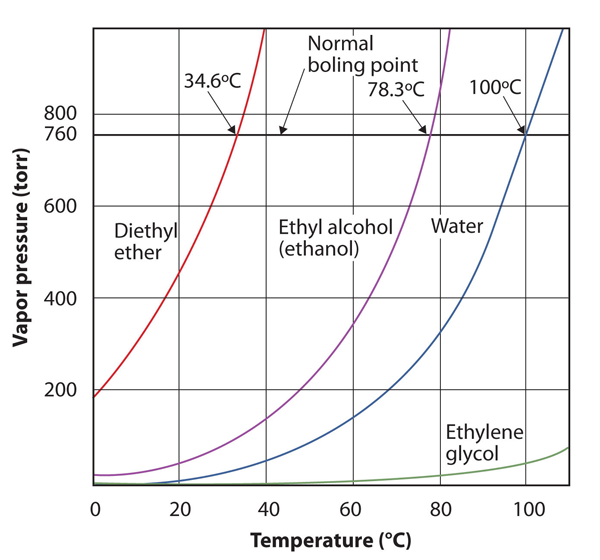
Der Dampfdruck einer Flüssigkeit hängt von der Identität der Flüssigkeit und der Temperatur ab, wie diese Grafik zeigt.
Beispiel 4
Verwenden Sie Abbildung 10.8 „Diagramme des Dampfdrucks gegenüber der Temperatur für mehrere Flüssigkeiten“, um den Siedepunkt von Wasser bei 500 torr abzuschätzen, was dem ungefähren atmosphärischen Druck am Gipfel des Mount Everest entspricht.
Lösung
Siehe die beigefügte Abbildung. Fünfhundert Torr liegen zwischen 400 und 600, also verlängern wir eine Linie von diesem Punkt auf der y-Achse bis zur Kurve für Wasser und lassen sie dann auf die x-Achse fallen, um die zugehörige Temperatur abzulesen. Es sieht so aus, als ob der Punkt auf der Wasserdampfdruckkurve einer Temperatur von etwa 90 ° C entspricht, so dass wir schließen, dass der Siedepunkt von Wasser bei 500 torr 90° C beträgt.
Abbildung 10.9 Mit Abbildung 10.8 „Diagramme des Dampfdrucks gegen Temperatur für mehrere Flüssigkeiten“ zur Beantwortung von Beispiel 4
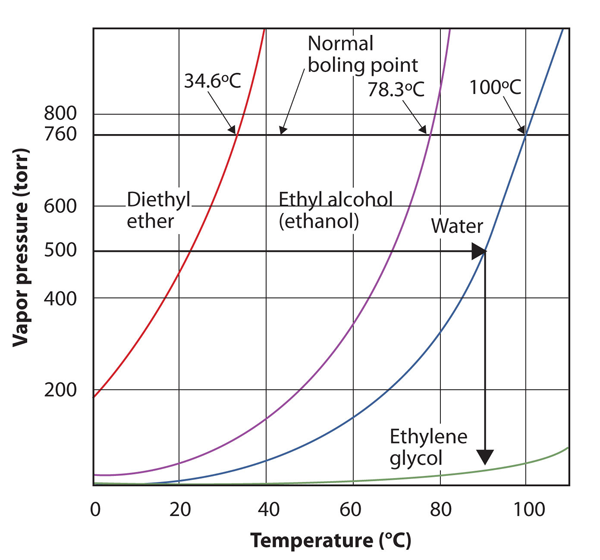
Wenn Sie die Grafik richtig lesen, können Sie den Siedepunkt einer Flüssigkeit bei verschiedenen Temperaturen abschätzen.
Testen Sie sich selbst
Verwenden Sie Abbildung 10.8 „Diagramme des Dampfdrucks gegenüber der Temperatur für mehrere Flüssigkeiten“, um den Siedepunkt von Ethanol bei 400 torr abzuschätzen.
Antwort
etwa 65°C
Die Dampfdruckkurve für Wasser ist am Schmelzpunkt—0°C – nicht genau Null. Selbst Eis hat einen Dampfdruck; deshalb sublimiert es im Laufe der Zeit. Die Dampfdrücke von Feststoffen sind jedoch typischerweise viel niedriger als die von Flüssigkeiten. Bei -1°C beträgt der Dampfdruck von Eis 4,2 torr. Bei einer Gefriertemperatur von 0 ° F (-17 ° C) beträgt der Dampfdruck von Eis nur 1,0 torr; Sogenannte Tiefkühltruhen können bis zu -23 ° C erreichen, wobei der Dampfdruck von Eis nur 0,6 Torr beträgt.
Phasendiagramme
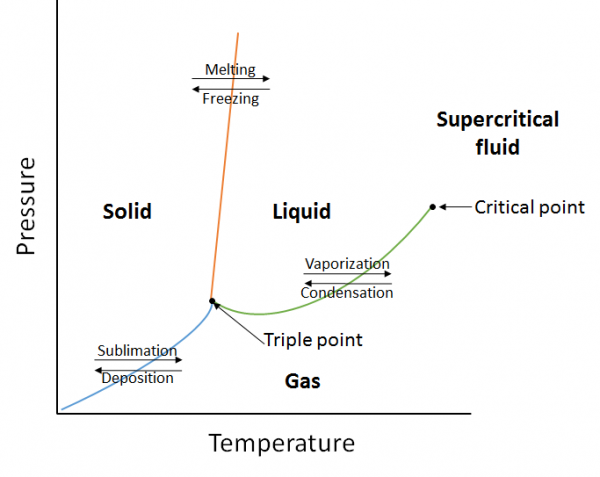
Ein Phasendiagramm ist eine grafische Darstellung der Gleichgewichtsbeziehungen, die zwischen den Phasen eines Stoffes unter bestimmten Drücken und Temperaturen bestehen (Abbildung 10.10). Das Phasendiagramm ist eine Kombination aus drei Kurven: der Dampfdruckkurve, der Schmelzkurve und der Sublimationskurve. Wir haben zuvor gesehen, dass Dampfdruckkurven das Gleichgewicht zwischen der Flüssigkeits- und Gasphase darstellen, und der Punkt, an dem der Druck 1 atm entspricht, ist der normale Siedepunkt. Ein weiteres Merkmal dieser Kurve im Phasendiagramm (grün) ist, dass sie am kritischen Punkt endet. Der kritische Punkt ist der Punkt bei der höchsten Temperatur und dem höchsten Druck, an dem Flüssigkeiten und Gase unterscheidbar bleiben. Bei Temperaturen und Druck jenseits dieses Punktes existiert die Materie in einer Phase mit Eigenschaften von Flüssigkeiten und Gasen, die als überkritische Flüssigkeit bekannt sind.
Die Schmelzkurve (orange) stellt das Gleichgewicht zwischen Fest und flüssig dar, und der Punkt, an dem der Druck 1 atm entspricht, ist der normale Schmelzpunkt. Die Sublimationskurve (blau) stellt das Gleichgewicht zwischen Feststoff und Gas dar. Schließlich wird der Punkt, an dem sich alle drei Kurven treffen, als Tripelpunkt bezeichnet. Zu diesem Zeitpunkt befinden sich alle drei Phasen (fest, flüssig und gasförmig) im Gleichgewicht.
Beispiel:
Bestimmen Sie anhand des folgenden Phasendiagramms, was passieren würde, wenn:
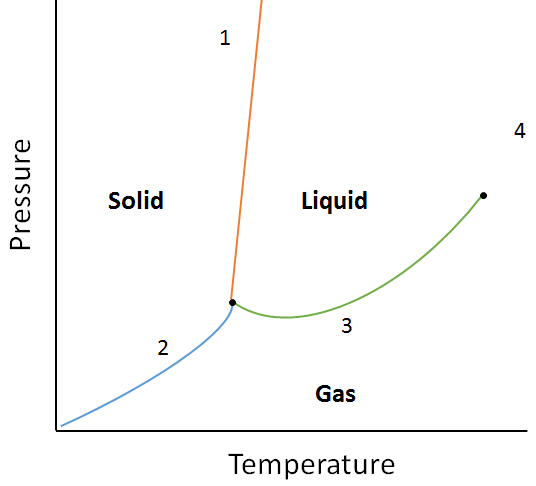
a. Die Temperatur wird für Materie an Punkt 1 erhöht.
b. Der Druck wird für Materie an Punkt 3 erhöht.
Lösung:
a. Materie an Punkt 1 schmilzt (ändert die Phase von fest zu flüssig), wenn die Temperatur erhöht wird.
b. Materie an Punkt 3 kondensiert (Wechselphase von Gas zu Flüssigkeit), wenn die Temperatur erhöht wird.
Oberflächenspannung und Kapillarwirkung
Alle Flüssigkeiten teilen auch einige andere Eigenschaften. Die Oberflächenspannung ist ein Effekt, der durch ein Ungleichgewicht der Kräfte auf die Atome an der Oberfläche einer Flüssigkeit verursacht wird, wie in Abbildung 10.11 „Oberflächenspannung“ gezeigt. Das blaue Teilchen in der Masse der Flüssigkeit erfährt intermolekulare Kräfte von überall her, wie durch die Pfeile dargestellt. Das gelbe Partikel auf der Oberfläche erfährt jedoch keine Kräfte darüber, da sich keine Partikel darüber befinden. Dies führt zu einem Ungleichgewicht der Kräfte, das wir Oberflächenspannung nennen.
Abbildung 10.11 Oberflächenspannung

Die Oberflächenspannung ergibt sich aus der Tatsache, dass Partikel an der Oberfläche einer Flüssigkeit keine Wechselwirkungen aus allen Richtungen erfahren, was zu einem Ungleichgewicht der Kräfte auf der Oberfläche führt.
Abbildung 10.12 Auswirkungen der Oberflächenspannung
