Mupirocin Creme
Generischer Name: Mupirocin Calcium
Darreichungsform: Creme
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am Jan 1, 2021.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professional
- Schwangerschaft
- Mehr
Indikationen und Verwendung für Mupirocin Creme
Mupirocin Creme USP, 2% ist angezeigt für die behandlung von sekundär infizierten traumatischen haut läsionen (bis zu 10 cm in länge oder 100 cm2 in bereich) aufgrund anfällig isolate von Staphylococcus aureus (S. aureus) und Streptococcus pyogenes (S. pyogenes).
Mupirocin Creme Dosierung und Verabreichung
- Nur zur topischen Anwendung.
- Tragen Sie eine kleine Menge Mupirocin-Creme mit einem Wattestäbchen oder Mulltuch 10 Tage lang 3-mal täglich auf die betroffene Stelle auf.
- Bedecken Sie den behandelten Bereich auf Wunsch mit einem Mullverband.
- Neubewertung von Patienten, die innerhalb von 3 bis 5 Tagen kein klinisches Ansprechen zeigten.
- Mupirocin Cream ist nicht zur intranasalen, ophthalmischen oder anderen Schleimhautanwendung bestimmt.
- Tragen Sie Mupirocin Cream nicht gleichzeitig mit anderen Lotionen, Cremes oder Salben auf .
Dosierungsformen und Stärken
Mupirocin Cream USP, 2% ist eine weiße Creme, die 20 mg (2% w/ w) Mupirocin pro Gramm in einer Emulsion auf Öl- und Wasserbasis enthält, die in 15-Gramm- und 30-Gramm-Röhrchen geliefert wird.
Kontraindikationen
Mupirocin-Creme ist bei Patienten mit bekannter Überempfindlichkeit gegen Mupirocin oder einen der sonstigen Bestandteile von Mupirocin-Creme kontraindiziert.
Warnhinweise und Vorsichtsmaßnahmen
Schwere allergische Reaktionen
Systemische allergische Reaktionen, einschließlich Anaphylaxie, Urtikaria, Angioödem und generalisierter Hautausschlag, wurden bei Patienten berichtet, die mit Formulierungen von Mupirocin, einschließlich Mupirocin-Creme, behandelt wurden .
Augenreizung
Kontakt mit den Augen vermeiden. Bei versehentlichem Kontakt gut mit Wasser abspülen.
Lokale Reizung
Im Falle einer Sensibilisierung oder einer schweren lokalen Reizung durch Mupirocin-Creme sollte die Anwendung abgebrochen und eine geeignete alternative Therapie für die Infektion eingeleitet werden.
Clostridium difficile-Assoziierte Diarrhoe
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde unter Verwendung fast aller antibakteriellen Mittel berichtet und kann in ihrem Schweregrad von leichter Diarrhoe bis hin zu tödlicher Kolitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem Überwachsen von C. difficile führt.
C. difficile produziert Toxine A und B, die zur Entwicklung von CDAD beitragen. Hypertoxin-produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegen eine antimikrobielle Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach dem Gebrauch antibakterieller Arzneimittel Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD über 2 Monate nach Verabreichung antibakterieller Mittel auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss der anhaltende antibakterielle Drogenkonsum, der nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinsupplementierung, eine antibakterielle Behandlung von C. difficile und eine chirurgische Untersuchung sollten nach klinischer Indikation eingeleitet werden.
Potenzial für mikrobielles Überwachsen
Wie bei anderen antibakteriellen Produkten kann eine längere Anwendung von Mupirocin-Creme zu einem Überwachsen nicht empfänglicher Mikroorganismen, einschließlich Pilzen, führen .
Risiko im Zusammenhang mit der Anwendung auf der Schleimhaut
Mupirocin Cream ist nicht zur Anwendung auf Schleimhautoberflächen bestimmt. Eine separate Formulierung, Mupirocin Calcium Nasensalbe, ist für die intranasale Anwendung verfügbar.
Nebenwirkungen
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
- Schwere allergische Reaktionen
- Augenreizung
- Lokale Reizung
- Clostridium difficile-Assoziierte Diarrhoe
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien mit einem Arzneimittel beobachteten Nebenreaktionsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
In 2 randomisierten, doppelblinden Doppel-Dummy-Studien wurden 339 Probanden mit topischer Mupirocin-Creme plus oralem Placebo behandelt. Nebenwirkungen traten bei 28 (8,3%) Probanden auf. Die folgenden Nebenwirkungen wurden von mindestens 1% der Probanden im Zusammenhang mit der Anwendung von Mupirocin-Creme in klinischen Studien berichtet: Kopfschmerzen (1,7%), Hautausschlag (1,1%) und Übelkeit (1,1%).
Andere Nebenwirkungen, die bei weniger als 1% der Probanden auftraten, waren: Bauchschmerzen, Brennen an der Applikationsstelle, Cellulitis, Dermatitis, Schwindel, Pruritus, sekundäre Wundinfektion und ulzerative Stomatitis.
In einer unterstützenden Studie zur Behandlung von sekundär infizierten Ekzemen wurden 82 Probanden mit Mupirocin-Creme behandelt. Die Häufigkeit von Nebenwirkungen war wie folgt: Übelkeit (4,9%), Kopfschmerzen und Brennen an der Applikationsstelle (jeweils 3,6%), Pruritus (2,4%) und jeweils 1 Bericht über Bauchschmerzen, Blutungen infolge von Ekzemen, Schmerzen infolge von Ekzemen, Nesselsucht, trockene Haut und Hautausschlag.
Erfahrungen nach Markteinführung
Zusätzlich zu den Nebenwirkungen, die in klinischen Studien berichtet wurden, wurden die folgenden Reaktionen während der Anwendung von Mupirocin-Creme nach Markteinführung festgestellt. Da sie freiwillig aus einer Population unbekannter Größe gemeldet werden, können keine Schätzungen der Häufigkeit vorgenommen werden. Diese Reaktionen wurden aufgrund einer Kombination aus Schweregrad, Häufigkeit der Berichterstattung oder potenziellem Kausalzusammenhang mit Mupirocin-Creme für die Aufnahme ausgewählt.
Störungen des Immunsystems
Systemische allergische Reaktionen, einschließlich Anaphylaxie, Urtikaria, Angioödem und generalisiertem Hautausschlag .
ANWENDUNG IN BESTIMMTEN POPULATIONEN
Schwangerschaft
Risikoübersicht
Es liegen keine ausreichenden Humandaten vor, um festzustellen, ob mit Mupirocin-Creme bei Schwangeren ein arzneimittelbedingtes Risiko besteht. Die systemische Resorption von Mupirocin durch intakte menschliche Haut ist nach topischer Verabreichung von Mupirocin-Creme minimal. Bei Ratten oder Kaninchen, die während der Organogenese subkutan mit Mupirocin in Dosen von 160 mg bzw. 40 mg pro kg und Tag behandelt wurden (22- bzw. 11-fache der topischen Dosis beim Menschen, basierend auf Berechnungen der Dosis geteilt durch die gesamte Körperoberfläche), wurde keine Entwicklungstoxizität beobachtet.
Das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Das geschätzte Hintergrundrisiko in der US-amerikanischen Allgemeinbevölkerung für schwere Geburtsfehler liegt bei 2% bis 4% und für Fehlgeburten bei 15% bis 20% der klinisch anerkannten Schwangerschaften.
Daten
Tierdaten: Es wurden Studien zur Entwicklungstoxizität mit Mupirocin durchgeführt, das Ratten und Kaninchen in Dosen von bis zu 160 mg pro kg und Tag während der Organogenese subkutan verabreicht wurde. Diese Dosis ist 22 und 43mal beziehungsweise die menschliche aktuelle Dosis (ungefähr 60 Mg mupirocin pro Tag) basiert auf Berechnungen der Dosis, die durch die gesamte Körperoberfläche geteilt ist. Maternale Toxizität wurde bei beiden Spezies beobachtet (Körpergewichtsverlust/verminderte Körpergewichtszunahme und verringerte Fütterung), ohne Hinweise auf Entwicklungstoxizität bei Ratten. Bei Kaninchen schloss eine übermäßige maternale Toxizität bei der hohen Dosis die Bewertung der fetalen Ergebnisse aus. Es gab keine Entwicklungstoxizität bei Kaninchen bei 40 mg pro kg pro Tag, dem 11-fachen der topischen Dosis beim Menschen, basierend auf Berechnungen der Dosis geteilt durch die gesamte Körperoberfläche.
Mupirocin, das Ratten in einer prä- und postnatalen Entwicklungsstudie (dosiert während der späten Trächtigkeit bis zur Laktation) subkutan verabreicht wurde, war in einer Dosis von 106 mit einer verringerten Lebensfähigkeit der Nachkommen in der frühen postnatalen Phase verbunden.7 mg pro kg bei Reizung der Injektionsstelle und/oder subkutanen Blutungen. Diese Dosis ist 14mal die menschliche aktuelle Dosis, die auf Berechnungen der Dosis basiert ist, die durch die gesamte Körperoberfläche geteilt ist. Das nicht beobachtete Nebenwirkungsniveau in dieser Studie betrug 44,2 mg pro kg pro Tag, was dem 6-fachen der topischen Dosis beim Menschen entspricht.
Laktation
Risikoübersicht
Es ist nicht bekannt, ob Mupirocin in der Muttermilch vorhanden ist, Auswirkungen auf das gestillte Kind hat oder Auswirkungen auf die Milchproduktion hat. Es ist jedoch nicht zu erwarten, dass das Stillen aufgrund der minimalen systemischen Resorption von Mupirocin beim Menschen nach topischer Verabreichung von Mupirocin-Creme zu einer Exposition des Kindes gegenüber dem Arzneimittel führt . Die entwicklungs- und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Mupirocin-Creme und möglichen nachteiligen Auswirkungen von Mupirocin-Creme oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Klinische Überlegungen
Um die orale Exposition des Arzneimittels bei Kindern zu minimieren, sollte eine mit Mupirocin-Creme behandelte Brust und / oder Brustwarze vor dem Stillen gründlich gewaschen werden.
Pädiatrische Anwendung
Die Sicherheit und Wirksamkeit von Mupirocin-Creme wurde in den Altersgruppen von 3 Monaten bis 16 Jahren nachgewiesen. Die Anwendung von Mupirocin-Creme in diesen Altersgruppen wird durch Evidenz aus adäquaten und gut kontrollierten Studien mit Mupirocin-Creme bei Erwachsenen mit zusätzlichen Daten von 93 pädiatrischen Probanden unterstützt, die im Rahmen der Zulassungsstudien bei Erwachsenen untersucht wurden .
Geriatrische Anwendung
In 2 adäquaten und gut kontrollierten Studien wurden 30 Probanden, die älter als 65 Jahre waren, mit Mupirocin-Creme behandelt. Bei dieser Patientenpopulation wurde kein allgemeiner Unterschied in der Wirksamkeit oder Sicherheit von Mupirocin-Creme im Vergleich zu jüngeren Patienten beobachtet.
Mupirocin Creme Beschreibung
Mupirocin Creme USP, 2% enthält die dihydrat kristallines calcium hemi-salz der RNA synthetase inhibitor antibakterielle, mupirocin. Chemisch ist es (aE,2S,3R,4R,5S) -5-Tetrahydro-3,4-dihydroxy-ß-methyl-2H-pyran-2-crotonsäure, Ester mit 9-hydroxynonansäure, Calciumsalz (2:1), Dihydrat.
Die Summenformel von Mupirocin-Calcium lautet (C26H43O9)2Ca∙2H2O und das Molekulargewicht beträgt 1075,3. Das Molekulargewicht der freien Mupirocinsäure beträgt 500,6. Die Strukturformel von Mupirocin Calcium lautet:
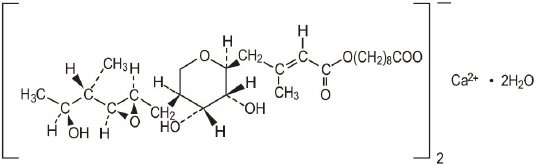
Jedes Gramm Mupirocin-Creme enthält 20 mg (2% w/ w) Mupirocin entsprechend 21,5 mg (2,15% w/ w) Mupirocin Calcium. The inactive ingredients are benzyl alcohol, cetomacrogol 1000, cetyl alcohol, mineral oil, phenoxyethanol, purified water, stearyl alcohol, and xanthan gum.
Mupirocin Cream – Clinical Pharmacology
Mechanism of Action
Mupirocin is an RNA synthetase inhibitor antibacterial .
Pharmacokinetics
Absorption
Systemic absorption of mupirocin through intact human skin is minimal. Die systemische Resorption von Mupirocin wurde nach Anwendung von Mupirocin-Creme 3-mal täglich über 5 Tage bei verschiedenen Hautläsionen mit einer Länge von mehr als 10 cm oder einer Fläche von 100 cm2 bei 16 Erwachsenen (im Alter von 29 bis 60 Jahren) und 10 Kindern (im Alter von 3 bis 12 Jahren) untersucht. Eine gewisse systemische Resorption wurde beobachtet, was durch den Nachweis des Metaboliten Moninsäure im Urin belegt wurde. Daten aus dieser Studie zeigten ein häufigeres Auftreten einer perkutanen Resorption bei Kindern (90% der Probanden) im Vergleich zu Erwachsenen (44% der Probanden); die beobachteten Harnkonzentrationen bei Kindern (0, 07 bis 1.3 mcg pro ml) liegen innerhalb des beobachteten Bereichs (0,08 bis 10,03 mcg pro ml) in der erwachsenen Bevölkerung. Im Allgemeinen scheint der Grad der perkutanen Resorption nach Mehrfachdosierung bei Erwachsenen und Kindern minimal zu sein.
Die Wirkung der gleichzeitigen Anwendung von Mupirocin-Creme mit anderen topischen Produkten wurde nicht untersucht .
Elimination
In einer Studie mit 7 gesunden erwachsenen männlichen Probanden betrug die Eliminationshalbwertszeit nach intravenöser Verabreichung von Mupirocin 20 bis 40 Minuten für Mupirocin und 30 bis 80 Minuten für Moninsäure.
Stoffwechsel: Nach intravenöser oder oraler Verabreichung wird Mupirocin schnell metabolisiert. Der Hauptmetabolit, Moninsäure, zeigt keine antibakterielle Aktivität.
Ausscheidung: Moninsäure wird überwiegend renal ausgeschieden.
Mikrobiologie
Mupirocin ist ein antibakterieller RNA-Synthetase-Inhibitor, der durch Fermentation unter Verwendung des Organismus Pseudomonas fluorescens hergestellt wird.
Wirkmechanismus
Mupirocin hemmt die bakterielle Proteinsynthese durch reversible und spezifische Bindung an bakterielle Isoleucyltransfer-RNA (tRNA) -Synthetase.
Mupirocin ist in Konzentrationen, die durch topische Verabreichung erreicht werden, bakterizid. Mupirocin ist stark proteingebunden (mehr als 97%) und die Wirkung von Wundsekreten auf die minimalen Hemmkonzentrationen (MICs) von Mupirocin wurde nicht bestimmt.
Resistenz
Wenn eine Mupirocin-Resistenz auftritt, resultiert sie aus der Produktion einer modifizierten Isoleucyl-tRNA-Synthetase oder dem Erwerb eines Plasmids, das eine neue Isoleucyl-tRNA-Synthetase vermittelt, durch Gentransfer. Hochgradige Plasmid-vermittelte Resistenzen (MHK ≥512 mcg /ml) wurden in zunehmender Anzahl von Isolaten von S. aureus und mit höherer Häufigkeit bei Koagulase-negativen Staphylokokken berichtet. Mupirocin-Resistenz tritt bei Methicillin-resistenten Staphylokokken häufiger auf als bei Methicillin-empfindlichen Staphylokokken.
Kreuzresistenz
Aufgrund seiner Wirkungsweise zeigt Mupirocin keine Kreuzresistenz mit anderen Klassen antimikrobieller Mittel.
Antimikrobielle Aktivität
Es wurde gezeigt, dass Mupirocin gegen empfindliche Isolate von S. aureus und S. pyogene, sowohl in vitro als auch in klinischen Studien . Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch unbekannt. Mupirocin ist gegen die meisten Isolate von Staphylococcus epidermidis aktiv.
Suszeptibilitätstestmethoden
Die hochgradige Mupirocinresistenz (≥512 mcg/ ml) kann unter Verwendung von Standarddiffusions- oder Bouillon-Mikrodilutionstests bestimmt werden.1,2 Wegen des Auftretens von Mupirocin-Resistenz bei Methicillin-resistentem S. aureus (MRSA) ist es angebracht, MRSA-Populationen vor der Anwendung von Mupirocin mit einer standardisierten Methode auf Mupirocin-Empfindlichkeit zu testen.3,4,5
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Langzeitstudien an Tieren zur Bewertung des kanzerogenen Potenzials von Mupirocin-Calcium wurden nicht durchgeführt.
Die Ergebnisse der folgenden Studien mit Mupirocin Calcium oder Mupirocin Natrium in vitro und in vivo zeigten kein Genotoxizitätspotenzial: außerplanmäßige DNA-Synthese von primären Hepatozyten bei Ratten, Sedimentanalyse auf DNA-Strangbrüche, Salmonellen-Reversionstest (Ames), Escherichia coli-Mutationstest, Metaphasenanalyse humaner Lymphozyten, Mauslymphom-Assay und Knochenmark-Mikronuklei-Assay bei Mäusen.
In einer Fertilitäts- / Reproduktionsleistungsstudie (mit Dosierung über die Laktation) führte die subkutane Verabreichung von Mupirocin an männliche und weibliche Ratten in Dosen von bis zu 100 mg pro kg und Tag, was dem 14-fachen der topischen Dosis beim Menschen entspricht (ungefähr 60 mg Mupirocin pro Tag), basierend auf Berechnungen der Dosis geteilt durch die gesamte Körperoberfläche, nicht zu einer Beeinträchtigung der Fertilität oder der Reproduktionsleistung, die auf Mupirocin zurückzuführen ist.
Klinische Studien
Die Wirksamkeit von topischer Mupirocin-Creme zur Behandlung von sekundär infizierten traumatischen Hautläsionen (z., Schnittwunden, vernähte Wunden und Abschürfungen von nicht mehr als 10 cm Länge oder 100 cm2 Gesamtfläche) wurde in 2 randomisierten, doppelblinden, Doppel-Dummy-klinischen Studien mit dem von oralem Cephalexin verglichen. Die klinischen Wirksamkeitsraten bei der Nachbeobachtung in den Pro-Protokoll-Populationen (Erwachsene und pädiatrische Probanden eingeschlossen) betrugen 96,1% für Mupirocin-Creme (n = 231) und 93,1% für orales Cephalexin (n = 219). Die Eradikationsraten der Erreger bei der Nachbeobachtung in den Pro-Protokoll-Populationen betrugen 100% sowohl für Mupirocin-Creme als auch für orales Cephalexin.
Pädiatrie
Es wurden 93 pädiatrische Probanden im Alter von 2 Wochen bis 16 Jahren pro Protokoll in die sekundär infizierten Hautläsionsstudien aufgenommen, obwohl nur 3 in der mit Mupirocin-Creme behandelten Population jünger als 2 Jahre waren. Die Probanden wurden randomisiert entweder 10 Tage topische Mupirocin-Creme 3-mal täglich oder 10 Tage orales Cephalexin (250 mg 4-mal täglich für Probanden über 40 kg oder 25 mg pro kg pro Tag Suspension zum Einnehmen in 4 aufgeteilten Dosen für Probanden unter oder gleich 40 kg). Die klinische Wirksamkeit bei Follow-up (7 bis 12 Tage nach der Therapie) in den Pro-Protokoll-Populationen betrug 97,7% (43 von 44) für Mupirocin-Creme und 93,9% (46 von 49) für Cephalexin.
- Institut für klinische und Laborstandards (CLSI). Leistungsstandards für antimikrobielle Empfindlichkeitstests; Sechsundzwanzigste Informationsergänzung. CLSI-Dokument M100-S26. Institut für klinische und Laborstandards, 950 West Valley Rd., Suite 2500, Wayne, PA 19087, Vereinigte Staaten, 2016.
- Patel J, Gorwitz RJ, et al. Mupirocin-Resistenz. Klinische Infektionskrankheiten. 2009; 49(6):935-41.
- Institut für klinische und Laborstandards (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard – Zehnte Ausgabe. CLSI-Dokument M07-A10. Institut für klinische und Laborstandards, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
- Institut für klinische und Laborstandards (CLSI). Leistungsstandards für antimikrobielle Scheibendiffusionsempfindlichkeitstests; Genehmigte Norm – Zwölfte Auflage. CLSI-Dokument M02-A12. Institut für klinische und Laborstandards, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
- Finlay JE, Miller LA, Poupard JA. Interpretationskriterien zum Testen der Empfindlichkeit von Staphylokokken gegenüber Mupirocin. Antimikrobielle Mittel Chemother 1997; 41(5): 1137-1139.
Wie geliefert/Lagerung und Handhabung
Mupirocin-Creme ist eine weiße Creme, die 20 mg (2 Gew.-%) Mupirocin pro Gramm in einer Emulsion auf Öl-Wasser-Basis enthält.
Mupirocin Creme USP, 2% wird in 15-Gramm (NDC 16714-055-01) und 30-Gramm (NDC 16714-055-02) Röhrchen geliefert.
Bei 20° bis 25°C (68° bis 77°F) lagern. Nicht einfrieren.
Informationen zur Patientenberatung
Empfehlen Sie dem Patienten, die von der FDA zugelassene Patientenetikettierung (Patienteninformation) zu lesen.
Raten Sie dem Patienten, Mupirocin-Creme wie folgt zu verabreichen:
- Verwenden Sie Mupirocin-Creme nur nach Anweisung des Gesundheitsdienstleisters. Es ist nur zur äußerlichen Anwendung bestimmt. Vermeiden Sie den Kontakt von Mupirocin Creme mit den Augen. Wenn Mupirocin-Creme in die Augen gelangt, gründlich mit Wasser abspülen.
- Verwenden Sie keine Mupirocin-Creme in der Nase.
- Waschen Sie Ihre Hände vor und nach dem Auftragen der Mupirocin-Creme.
- Verwenden Sie ein Mulltuch oder ein Wattestäbchen, um eine kleine Menge Mupirocin-Creme auf die betroffene Stelle aufzutragen. Der behandelte Bereich kann, falls gewünscht, mit einem Mullverband bedeckt werden.
- Melden Sie dem Arzt alle Anzeichen lokaler Nebenwirkungen. Mupirocin-Creme sollte abgesetzt und der Arzt kontaktiert werden, wenn Reizungen, starker Juckreiz oder Hautausschlag auftreten.
- Melden Sie sich beim Arzt oder gehen Sie in die nächstgelegene Notaufnahme, wenn schwere allergische Reaktionen wie Schwellungen der Lippen, des Gesichts oder der Zunge oder Keuchen auftreten .
- Wenn innerhalb von 3 bis 5 Tagen keine Besserung festgestellt wird, wenden Sie sich an den Arzt.Hergestellt für: Northstar RxLLC Memphis, TN 38141.Hergestellt von: Taro Pharmaceuticals Inc.Brampton, Ontario, Kanada L6T 1C1.
Ausgabe: November 2020
5214500
54Diese Patienteninformation wurde von der US-amerikanischen Food and Drug Administration genehmigt.
Ausgestellt: November 2020 5214500 54PATIENTENINFORMATION
MUPIROCIN (mue pir’oh sin) CREME zur topischen AnwendungWas ist Mupirocin-Creme?
Mupirocin Creme ist ein verschreibungspflichtiges Arzneimittel auf der Haut (topische Anwendung) verwendet, um bestimmte Hautinfektionen durch Bakterien namens Staphylococcus aureus und Streptococcus pyogenes verursacht zu behandeln. Es ist nicht bekannt, ob Mupirocin-Creme bei Kindern unter 3 Monaten sicher und wirksam ist.Wer sollte Mupirocin-Creme nicht verwenden?
Verwenden Sie Mupirocin Cream nicht, wenn:- Sie allergisch gegen Mupirocin oder einen der Inhaltsstoffe in Mupirocin Cream sind. Eine vollständige Liste der Inhaltsstoffe von Mupirocin Cream finden Sie am Ende dieser Packungsbeilage.
Was sollte ich Meinem Arzt vor der Anwendung von Mupirocin-Creme mitteilen?
Vor der Verwendung von Mupirocin Creme, informieren Sie Ihren Arzt über alle Ihre medizinischen Bedingungen, einschließlich, wenn Sie:- schwanger sind oder planen, schwanger zu werden. Es ist nicht bekannt, ob Mupirocin-Creme Ihrem ungeborenen Kind schadet.
- stillen oder planen zu stillen. Es ist nicht bekannt, ob Mupirocin-Creme in die Muttermilch übergeht. Sie und Ihr Arzt sollten entscheiden, ob Sie Mupirocin-Creme während des Stillens anwenden können.
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. Mischen Sie Mupirocin-Creme nicht mit anderen Lotionen, Cremes oder Salben.
Wie sollte ich Mupirocin Creme verwenden? - Mupirocin-Creme ist zur Anwendung auf der Haut (topisch) bestimmt. Erhalten Sie keine Mupirocin-Creme in Ihre Augen, Nase, Mund oder Vagina (Schleimhautoberflächen).
- Verwenden Sie Mupirocin Creme genau so, wie Ihr Arzt Ihnen sagt, es zu benutzen.
- Tragen Sie 3 mal täglich eine kleine Menge Mupirocin-Creme mit einem Wattestäbchen oder Mulltuch auf die betroffene Stelle auf. Tragen Sie Mupirocin Creme für 10 Tage.
- Es ist wichtig, dass Sie den gesamten Verlauf der Mupirocin-Creme einnehmen. Hören Sie nicht früh auf, da Ihre Symptome verschwinden können, bevor die Infektion vollständig beseitigt ist.
- Waschen Sie Ihre Hände vor und nach dem Auftragen der Mupirocin-Creme.
- Nach dem Auftragen der Mupirocin-Creme können Sie den behandelten Bereich mit einem sauberen Mulltuch abdecken, es sei denn, Ihr Arzt hat Ihnen gesagt, dass Sie ihn unbedeckt lassen sollen.
- Sprechen Sie mit Ihrem Arzt, wenn sich Ihre Haut nach 3 bis 5 Tagen Behandlung mit Mupirocin-Creme nicht bessert.
- Wenn Sie stillen und Mupirocin-Creme auf Ihre Brust oder Brustwarze auftragen, waschen Sie den Bereich gut, bevor Sie Ihr Kind stillen.
Was sind die möglichen Nebenwirkungen von Mupirocin Creme?
Mupirocin Creme kann zu schweren Nebenwirkungen, einschließlich:- schwere allergische Reaktionen. Hören Sie auf, Mupirocin-Creme zu verwenden, und rufen Sie Ihren Arzt an oder gehen Sie sofort in die nächstgelegene Notaufnahme, wenn Sie eines der folgenden Anzeichen oder Symptome einer schweren allergischen Reaktion haben:
- Nesselsucht
- Schwellung von Gesicht, Lippen, Mund oder Zunge
- Hautausschlag am ganzen Körper
- Schwierigkeiten beim Atmen oder Keuchen
- Schwindel, schneller Herzschlag oder Klopfen in der Brust
- Augenreizung. Holen Sie sich keine Mupirocin-Creme in Ihre Augen. Wenn Mupirocin-Creme in Ihre Augen gelangt, spülen Sie Ihre Augen gut mit Wasser aus.
- Reizung im Bereich Mupirocin Creme wird verwendet. Ein Hautausschlag kann nach der Anwendung von Mupirocin-Creme auftreten und schwerwiegend sein. Beenden Sie die Anwendung von Mupirocin Cream und rufen Sie Ihren Arzt an, wenn Sie während der Anwendung von Mupirocin Cream eine Reizung, starken Juckreiz oder Hautausschlag entwickeln.eine Art von Durchfall namens Clostridium difficile-assoziierte Diarrhoe (CDAD). CDAD kann bei Personen auftreten, die Arzneimittel zur Behandlung bakterieller Infektionen anwenden oder angewendet haben. Der Schweregrad der CDAD kann von leichtem Durchfall bis zu schwerem Durchfall reichen, der zum Tod führen kann (tödliche Kolitis). Rufen Sie Ihren Arzt an oder gehen Sie sofort in die nächstgelegene Notaufnahme, wenn Sie während der Anwendung oder nach Beendigung der Anwendung von Mupirocin-Creme Durchfall haben.
Die häufigsten Nebenwirkungen von Mupirocin-Creme sind:
- Kopfschmerzen
- Hautausschlag
- Übelkeit
Dies sind nicht alle möglichen Nebenwirkungen von Mupirocin-Creme. Rufen Sie Ihren Arzt an, um ärztlichen Rat zu Nebenwirkungen zu erhalten. Sie können Nebenwirkungen bei der FDA unter 1-800-FDA-1088 melden.
Wie sollte ich Mupirocin Creme lagern? - Shop Mupirocin Creme bei Raumtemperatur zwischen 68 ° F bis 77 ° F (20 ° C bis 25 ° C).
- Mupirocin-Creme nicht einfrieren.
- Bewahren Sie Mupirocin-Creme und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von Mupirocin-Creme.
Arzneimittel werden manchmal für andere als die in der Packungsbeilage aufgeführten Zwecke verschrieben. Verwenden Sie Mupirocin-Creme nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Mupirocin-Creme nicht an andere Personen weiter, auch wenn diese die gleichen Symptome haben wie Sie. Es kann ihnen schaden. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen zu Mupirocin-Creme fragen, die für Angehörige der Gesundheitsberufe geschrieben wurden.Was sind die Inhaltsstoffe in Mupirocin Creme?
Wirkstoff: Mupirocin Calcium
Inaktive Inhaltsstoffe: Benzylalkohol, Cetomacrogol 1000, Cetylalkohol, Mineralöl, Phenoxyethanol, gereinigtes Wasser, Stearylalkohol und Xanthangummi
Hergestellt für: Northstar RxLLC, Memphis, TN 38141.
Manufactured by: Taro Pharmaceuticals Inc., Brampton, Ontario, Canada L6T 1C1.
For more information, call 1-800-206-7821.PRINCIPAL DISPLAY PANEL – 30 g Tube Carton
NDC 16714-055-02
Rx onlyMupirocin Cream USP
2%
FOR DERMATOLOGIC USE ONLY.NORTHSTARx®
30 g
MUPIROCIN
mupirocin calcium creamProduct Information Product Type HUMAN PRESCRIPTION DRUG LABEL Item Code (Source) NDC:16714-055 Route of Administration TOPICAL DEA Schedule Active Ingredient/Active Moiety Ingredient Name Basis of Strength Strength Mupirocin Calcium (Mupirocin) Mupirocin 20 mg in 1 g Inactive Ingredients Ingredient Name Strength benzyl alcohol ceteth-20 cetyl alcohol mineral oil phenoxyethanol WATER stearyl alcohol xanthan gum Product Characteristics Color WHITE Score Shape Size Flavor Imprint Code Contains Packaging # Item Code Package Description 1 NDC:16714-055-01 1 TUBE in 1 CARTON 1 15 g in 1 TUBE 2 NDC:16714-055-02 1 TUBE in 1 CARTON 2 30 g in 1 TUBE Marketing Information Marketing Category Application Number or Monograph Citation Marketing Start Date Marketing End Date ANDA ANDA207116 11/25/2020 Etikettierer – NORTHSTAR RX LLC (830546433)
NORTHSTAR RX LLCHäufig gestellte Fragen
- Kann ich Mupirocin Salbe für Windeldermatitis verwenden?
- Kann Mupirocin bei Ekzemen heilen oder helfen?
- Kann Mupirocin bei Sportlern angewendet werden?
- Kann Mupirocin Creme für Dekubitus verwendet werden?
Mehr über mupirocin topisch
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Alternativen vergleichen
- Selbsthilfegruppe
- Preise & Gutscheine
- Spanisch
- 38 Bewertungen
- Arzneimittelklasse: topische Antibiotika
Verbraucherressourcen
- Patienteninformationen
- Mupirocin Nasal (Fortgeschrittenes Lesen)
- Mupirocin Topisch (fortgeschrittenes Lesen)
Professionelle Ressourcen
- Verschreibungsinformationen
- Mupirocin (Professionelle Patientenberatung)
- Mupirocin (FDA)
Andere Marken Bactroban, Bactroban Nasal, Centany, Centany AT, Pirnuo
Verwandte Behandlungsanleitungen
- Nasale Beförderung von Staphylococcus aureus
- Haut- und Strukturinfektion
- Sekundäre kutane bakterielle Infektionen
- Impetigo
- Paronychie
Medizinischer Haftungsausschluss