Protein fordøyelse: trinn, enzymer og hormoner
kroppen krever proteiner, og spesielt de essensielle aminosyrene som finnes i dem. Anbefalt daglig inntak for en sunn voksenperson er 0,85 g / kg kroppsvekt, så for en 70 kg person er ca 60 g, men ofte i det typiske Vestlige dietten er inntaket større enn 100 g / dag.
i tillegg til matproteiner fordøyer kroppen også 50-100 g endogene proteiner utskilt eller tapt i lumen i mage-tarmkanalen, og som skyldes:
- spytt;
- magesaft;
- bukspyttkjertelenzymer og andre sekreter;
- tarmceller som flager av;
- proteiner som passerer inn i tarmlumen fra blodet.
denne blandingen fordøyes og absorberes effektivt i tolvfingertarmen, den første og korteste delen av tynntarmen, med et daglig tap gjennom avføring som tilsvarer omtrent 1,6 g nitrogen, tilsvarende 10 g protein. Det meste av det tapte nitrogenet brukes av mikrofloraen i tykktarmen for vekst, og dermed finnes det i avføringen som en del av bakteriemassen.
Innhold
fordøyelsesenzymer
proteinfordøyelse oppstår som et resultat av hydrolysen av peptidbindingene som binder de enkelte aminosyrene i polypeptidkjeden. Disse reaksjonene katalyseres av enzymer som kalles proteaser.
tarmproteaser, spesifikke for aminosyren sidekjeden, er hydrolaser som kan deles inn i to klasser:
- endopeptidaser, som hydrolyserer peptidbindinger i polypeptidkjeden, og produseres av magen og den eksokrine bukspyttkjertelen;
- eksopeptidaser, som kan deles inn i to grupper:
karboksypeptidasen, som fjerner aminosyrer fra C-terminal ende, og er produsert Av Eksokrine bukspyttkjertelen;
aminopeptidasen, som virker På Den n-terminale enden, og produseres av enterocytene.

disse enzymene syntetiseres og utskilles i en inaktiv form, kalt zymogener eller proenzymer.
i cellen lagres zymogener inne i membranbegrensede granulater kalt zymogengranuler. Når cellen stimuleres av det spesifikke signalet, frigjøres granulemembranen med plasmamembranen og zymogener ved eksocytose.disse proteasene syntetiseres i en inaktiv form for å unngå at de fordøyer seg selv og/eller vevsproteiner før de blir utskilt. Det som skjer er at det aktive stedet for enzymet er «maskert» og først etter aktivering kan proteinet virke på substratet. Aktiveringen er resultatet av spaltningen, katalysert av et bestemt enzym, av en eller flere spesifikke peptidbindinger, med frigjøring av ett eller flere segmenter av polypeptidkjeden. Dette gjør at molekylet kan anta en tredimensjonal konformasjon der det aktive stedet er gratis og riktig konfigurert.Selv deres akkumulering i granulatene er et beskyttelsessystem: det isolerer dem fra de andre molekylene som er tilstede i cellen.De fleste proteiner i deres opprinnelige konformasjon er resistente mot virkningen av proteaser. Dette er en konsekvens av deres sekundære og tertiære eller innfødte struktur som maskerer mange bindinger til virkningen av enzymer. Disse strukturene stabiliseres av kovalente bindinger, som disulfidbroer mellom cysteinrester og ikke-kovalente krefter, som ioniske interaksjoner, hydrogenbindinger og van Der Waals-krefter.for en tilstrekkelig proteinfordøyelse er det derfor viktig at peptidbindinger er så tilgjengelige som mulig for virkningen av tarmproteaser. Dette oppnås, utenfor kroppen gjennom matlaging av mat, og i kroppen av syremiljøet i magen.
rolle av matlaging og tygging av mat
tilberedningen av mat, når den ikke er overdreven, letter proteinfordøyelsen.
på hvilken måte?som alle molekyler er også proteiner ikke ubevegelige, men vibrerer. Når temperaturen øker, vibrerer proteinene med større amplitude, opp for å ødelegge de ikke-kovalente bindingene som bidrar til vedlikehold av den opprinnelige strukturen. Derfor oppstår en konformasjonsendring av proteinet, det vil si at molekylet er denaturert. Dette kan gjøre interne peptidbindinger mer tilgjengelige for virkningen av fordøyelsesenzymer.
selv tygge og insalivasjon av mat homogeniserer og fukter de faste komponentene i maten selv, noe som letter fordøyelsen av mage og tarm.
Stadier av proteinfordøyelse
to stadier er involvert i fordøyelsen av proteiner: den første forekommer i magen og den andre i i tolvfingertarmen, den første delen av tynntarmen.
Mage og protein fordøyelse
protein fordøyelse begynner i magen, og dette er et «forberedelsesstadium» i forhold til hendelsene som oppstår i tolvfingertarmen.tilstedeværelsen av mat i magen stimulerer g-celler i slimhinnen i mage antrum og proksimale tolvfingertarmen for å produsere og frigjøre hormonet gastrin i blodet. Hormonet stimulerer parietalcellene til de riktige magekjertlene, lokalisert hovedsakelig på bunnen av orgelet, for å produsere og utskille saltsyre i magen (parietalceller produserer også den indre faktoren, et protein som binder vitamin B12, forhindrer ødeleggelsen og tillater det å bli absorbert).
i de riktige magekjertlene fant du også:
- slimete nakkeceller, som produserer slim;
- sjefceller, som frigjør pepsinogen.
Alle disse stoffene, sammen med andre som kaliumioner og gastrisk lipase, er tilstede i magesaften, som har en pH som varierer mellom 1 og 2,5.på grunn av sin lave pH har magesaften en antiseptisk virkning, dreper de fleste bakterier og andre fremmede celler, og en denaturerende effekt, da den bryter de ikke-kovalente bindingene som opprettholder den opprinnelige strukturen av proteiner. Denne denatureringseffekten letter tilgangen av intestinal protease til peptidbindinger, som oppvarming under tilberedning. Noen proteiner rik på disulfidbindinger, som keratiner, er resistente mot denaturering ved lav pH, og dermed vanskelig å fordøye. Tvert imot blir de fleste globulære proteiner nesten fullstendig hydrolysert til bestanddeler av aminosyrer.endelig aktiverer den lave pH i magesaften pepsinogen, et zymogen, til pepsin, det første enzymet involvert i proteinfordøyelse.
protein fordøyelse og pepsin
det finnes forskjellige isoenzymer av pepsinogen, som type i, syntetisert av kroppens celler og fundus i magen, og TYPE II som produseres i alle organets regioner. Alle isoenzymer omdannes til det aktive enzymet. Aktiveringen skjer ved autokatalyse, ved pH-verdier under 5, ved en intramolekylær prosess som består i hydrolyse av en spesifikk peptidbinding og frigjøring av et lite peptid fra den n-terminale enden av proenzymet. Dette peptidet forblir bundet til enzymet og fortsetter å virke som en inhibitor til pH-verdien faller under 2, eller til den nedbrytes ytterligere av pepsin selv. Så, når noen pepsin er dannet, aktiverer dette raskt andre pepsinogenmolekyler.
Pepsin, en endopeptidase med en optimal ph-aktivitet ved 1,6, hydrolyserer 10-20% av proteinene i måltidet. Mange fordøyelsesenzymer er i stand til å virke på et bredt spekter av substrater, og pepsin er ikke noe unntak, katalyserer spaltningen av peptidbindinger ved siden av aminosyrerester som leucin og fenylalanin, tyrosin og tryptofan (aromatiske aminosyrer). En blanding av peptider av stor størrelse og noen få frie aminosyrer produseres.Pepsin handling er viktig ikke så mye for sin direkte bidrag til protein fordøyelsen, som er beskjeden, men for frigjøring av peptider og aminosyrer som, på duodenal nivå, stimulere utskillelsen av cholecystokinin,og derfor duodenal / pankreas fase av protein fordøyelsen(se nedenfor).Det skal bemerkes at virkningen av pepsin på kollagen, en familie av proteiner som vikler seg rundt og holder sammen muskelcellene, letter tilgangen til bukspyttkjertelproteasen til måltidsproteiner.
Duodenum og protein fordøyelse
når mageinnholdet passerer inn i tolvfingertarmen, stimulerer surheten S-celler, lokalisert i duodenal mucosa og i den proksimale delen av jejunum (neste del av tynntarmen), for å produsere og frigjøre hormon secretin i blodet. Hormonet forårsaker sekresjon av en alkalisk bukspyttkjertelsaft, rik på bikarbonationer, men dårlig i enzymer, som passerer inn i tolvfingertarmen gjennom bukspyttkjertelen. I tolvfingertarmen nøytraliserer den saltsyre produsert av magen, og øker pH til rundt 7 (nøytrale nivåer). Secretin stimulerer også galle sekresjon og reduserer gastrin utgivelse.tilstedeværelsen av aminosyrer i tolvfingertarmen stimulerer, som nevnt ovenfor, endokrine celler i tolvfingertarmen og jejunum for å produsere og frigjøre cholecystokinin (CKK) i blodet. Hormonet, blant andre funksjoner, stimulerer eksokrin bukspyttkjertel til å utskille en juice rik på enzymer (tilstede som zymogener), det er:trypsinogen, chymotrypsinogen og proelastase, endopeptidaser med forskjellig substratspesifisitet sammenlignet med pepsin, men også blant dem; procarboxypeptidase A Og B, eksopeptidaser som fjerner aminosyrer fra den c-terminale enden av peptidene.
derfor er det i tolvfingertarmen et nøytralt miljø rik på enzymer som kan fortsette, en gang aktivert, proteinfordøyelse. Videre, da proteasene har forskjellig substratspesifisitet, kan hvert peptid produsert av et enzym være substrat av et annet enzym.
i bukspyttkjertelen juice, amylase, lipase og nuklease er også til stede.
aktivering av pankreas zymogener
det første og mestersteget i aktiveringen er omdannelsen av trypsinogen til trypsin ved enteropeptidase (også kalt enterokinase), en endopeptidase produsert av celler i tolvfingertarmen etter cholecystokininstimulering. Enteropeptidase katalyserer spaltningen av en spesifikk peptidbinding mellom en lysinrest og en isoleucinrest av trypsinogenet, med frigjøring av et heksapeptid. Dette fører til en konformasjonell omlegging av proteinet som aktiverer det, det vil si trypsin dannes.enzymet spalter peptidbindinger ved siden av lysin-og argininrester av protein for å fordøye; dessuten kan det aktivere chymotrypsinogen, proelastase Og procarboxypeptidase A Og B, men også andre molekyler av trypsinogen, som pepsin (autokatalyse).
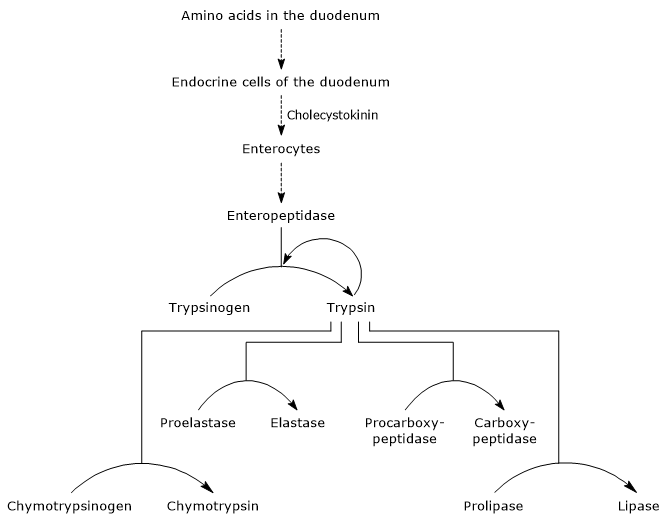
derfor øker duodenumets evne til å fordøye proteiner ettersom bukspyttkjertelen zymogener aktiveres, alle utløst av en liten mengde enteropeptidase.
- aktiveringen av chymotrypsinogen til chymotrypsin skjer gjennom forskjellige trinn som trypsin og det aktiverte chymotrypsin selv deltar i.
i det første trinnet katalyserer trypsin spaltningen av en spesifikk peptidbinding, og dette fører til aktivering av chymotrypsinogen til π-chymotrypsin, som er fullt aktiv. Deretter katalyserer π-chymotrypsin seg selv frigivelsen av to dipeptider med dannelse av δ-chymotrypsin, en mer stabil form av enzymet. δ-Chymotrypsin gjennomgår to konformasjonsendringer, hvorav den første fører til dannelsen av κ-chymotrypsin, og den andre av α-chymotrypsin, den endelige aktive formen av enzymet.
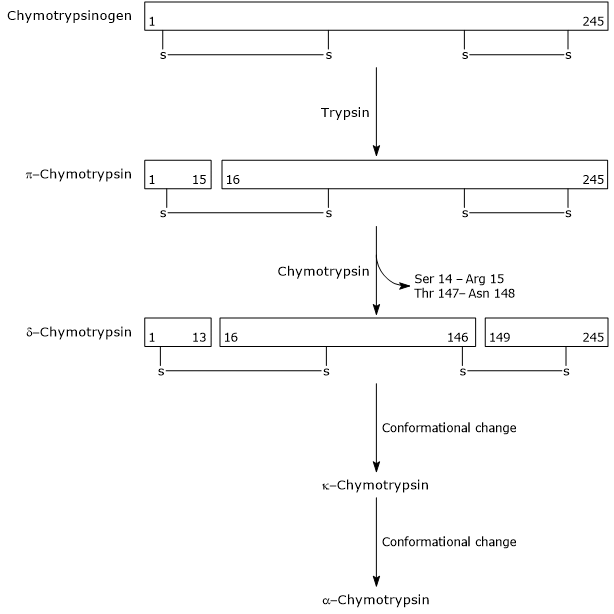
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.Elastase, som er mindre spesifikk enn de andre fordøyelseshydrolasene, katalyserer spaltningen av peptidbindinger ved siden av aminosyrer som glycin, alanin og serin.
- Procarboxypeptidase
Procarboxypeptidase a aktiveres til karboksypeptidase A; proteasen spalter peptidbindinger ved siden av aminosyrer med forgrenede eller aromatiske sidekjeder, som fenylalanin og valin.Procarboxypeptidase b aktiveres til karboksypeptidase B, spesifikk for aminosyrer med basiske sidekjeder, som lysin og arginin.
ovennevnte proteaser, i motsetning til pepsin, har en optimal ph-virkning fra7 til 8, det vil si nøytral eller svakt alkalisk.
Pankreatisk trypsininhibitor
det er et «ekstra» beskyttelsessystem mot intrapankreatisk trypsinaktivitet: syntesen av en inhibitor kalt «pankreatisk trypsininhibitor». Molekylet, tilstede i bukspyttkjertelen zymogengranuler, er i stand til å binde meget tett det aktive stedet for enzymet som inaktiverer det. På denne måten blokkeres aktiviteten til ethvert trypsin som følge av en for tidlig aktivering av trypsinogen, og forhindrer en situasjon der noen få aktiverte molekyler aktiverer alle bukspyttkjertelen zymogener.
i planter er det mange molekyler med lignende aktivitet. Et eksempel Er Kunitz trypsin-inhibitoren, et protein som hovedsakelig finnes i soyabønner, som danner et meget stabilt kompleks med det aktive stedet for trypsin.Siden de ovennevnte proteaser har en distinkt substratspesifisitet, som virker på peptidbindinger ved siden av forskjellige aminosyrer, kan hvert peptid generert av en protease være substrat av en annen. På denne måten blir de delvis fordøyede proteinene som kommer inn i tolvfingertarmen effektivt hydrolysert til frie aminosyrer og peptider med 2-8 rester. Disse peptidene er substrater av aminopeptidaser utskilt fra enterocytter og assosiert med deres mikrovilli.
Dipeptidase er også til stede.
det skal bemerkes at de samme proteasene endelig blir fordøyd, og avslutter prosessen.
betydningen og effektiviteten av proteolytiske enzymer i tarmproteinfordøyelsen kan forstås fra dette eksemplet. Hvis du in vitro ønsker å hydrolysere et protein i dets bestanddeler aminosyrer, er det nødvendig å bruke en sterk og konsentrert syre som katalysator og å varme prøven ved 105 ° c over natten. I tarmen oppnås det samme resultatet om noen timer, som først opererer i det relativt sure miljøet i magen, og deretter i de milde alkaliske forholdene i tolvfingertarmen, ved 37 °C.
de frigjorte aminosyrene, sammen med di – og tri-peptider, absorberes av enterocytter. Di-og tri-peptidene hydrolyseres vanligvis til aminosyrer i enterocytene, og dette forklarer hvorfor praktisk talt bare frie aminosyrer er tilstede i portalsirkulasjonen.
Bender D. A. Benders ‘ ordbok for ernæring og matteknologi. 8. Utgave. Woodhead Publishing (Engelsk). Oxford, 2006
Bender Da Introduksjon til ernæring og metabolisme. 3. Utgave. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L., Og Stryer L. Biokjemisk. 5. Utgave. Wh Freeman and Company, 2002
Bhagavan Nv, Ha C-E. Essentials of medical biochemistry: med kliniske tilfeller. 4. Utgave. Akademisk Presse, 2015
Cozzani I. Og Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Prinsipper for biokjemi. 4. Utgave. W. H. Freeman og Selskap, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal Md, Glew Rh Medisinsk Biokjemi: menneskelig metabolisme i helse og sykdom. John Wiley & Sons, INC., Publication, 2009
Stipanuk Mh, Caudill Ma Biokjemiske, fysiologiske og molekylære aspekter av menneskelig ernæring. 3. Utgave. Elsevier helsefag, 2013