2.1: Evolution of Atomic Theory
Atomic Theory after the Nineteenth Century
als materie uit atomen bestond, waaruit waren atomen dan samengesteld? Waren het de kleinste deeltjes, of was er iets kleiner? In de late jaren 1800, een aantal wetenschappers geïnteresseerd in vragen als deze onderzocht de elektrische ontladingen die kunnen worden geproduceerd in lagedrukgassen, met de belangrijkste ontdekking gedaan door de Engelse natuurkundige J. J. Thomson met behulp van een kathodestraalbuis. Dit apparaat bestond uit een gesloten glazen buis waaruit bijna alle lucht was verwijderd; de buis bevatte twee metalen elektroden. Wanneer hoogspanning werd toegepast over de elektroden, een zichtbare bundel genaamd een kathode straal verscheen tussen hen. Deze straal werd afgebogen naar de positieve lading en weg van de negatieve lading, en werd op dezelfde manier geproduceerd met identieke eigenschappen wanneer verschillende metalen werden gebruikt voor de elektroden. In soortgelijke experimenten werd de straal gelijktijdig afgebogen door een toegepast magnetisch veld, en metingen van de mate van afbuiging en de magnetische veldsterkte stelde Thomson in staat om de lading-massa verhouding van de kathodestraaldeeltjes te berekenen. De resultaten van deze metingen gaven aan dat deze deeltjes veel lichter waren dan atomen (figuur \(\Paginindex{1}\)).
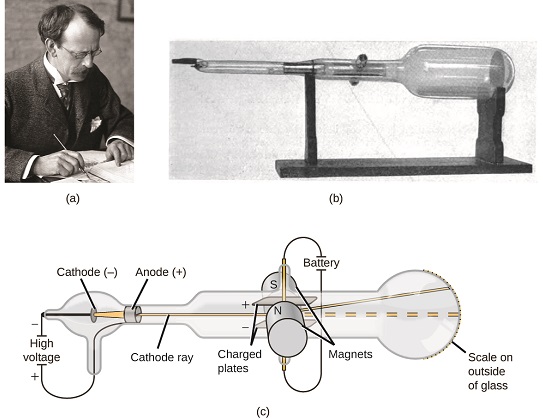
figuur \(\Paginindex{5}\): (A) J. J. Thomson produceerde een zichtbare bundel in een kathodestraalbuis. (b) Dit is een vroege kathodestraalbuis, uitgevonden in 1897 door Ferdinand Braun. (c) In de kathodestraal komt de bundel (in het geel afgebeeld) uit de kathode en wordt langs de anode versneld naar een fluorescerende schaal aan het einde van de buis. Door gelijktijdige afbuigingen door toegepaste elektrische en magnetische velden kon Thomson de massa-ladingsverhouding berekenen van de deeltjes waaruit de kathodestraal bestaat. (credit a: modification of work by Nobel Foundation; credit b: modification of work by Eugen Nesper; credit c: modification of work by “Kurzon”/Wikimedia Commons).
gebaseerd op zijn waarnemingen, is dit wat Thomson voorstelde en waarom: de deeltjes worden aangetrokken door positieve (+) ladingen en afgestoten door negatieve (−) ladingen, dus moeten ze negatief geladen zijn (zoals ladingen afstoten en in tegenstelling tot ladingen aantrekken); ze zijn minder massief dan atomen en niet te onderscheiden, ongeacht het bronmateriaal, dus moeten ze fundamentele, subatomaire bestanddelen van alle atomen zijn. Hoewel het destijds controversieel was, werd Thomson ‘ s idee geleidelijk geaccepteerd, en zijn kathodestraaldeeltje is wat we nu een elektron noemen, een negatief geladen subatomair deeltje met een massa meer dan duizend keer minder dan die van een atoom. De term “elektron “werd in 1891 bedacht door de Ierse natuurkundige George Stoney, uit” electric ion.”
in 1909 werd meer informatie over het elektron ontdekt door de Amerikaanse natuurkundige Robert A. Millikan via zijn” oil drop ” experimenten. Millikan creëerde microscopische oliedruppels, die elektrisch geladen konden worden door wrijving als ze gevormd werden of door het gebruik van röntgenstralen. Deze druppels vielen aanvankelijk door de zwaartekracht, maar hun neerwaartse vooruitgang kon worden vertraagd of zelfs omgekeerd door een elektrisch veld lager in het apparaat. Door het aanpassen van de elektrische veldsterkte en het maken van zorgvuldige metingen en de juiste berekeningen, was Millikan in staat om de lading op individuele druppels te bepalen (figuur \(\Paginindex{2}\)).
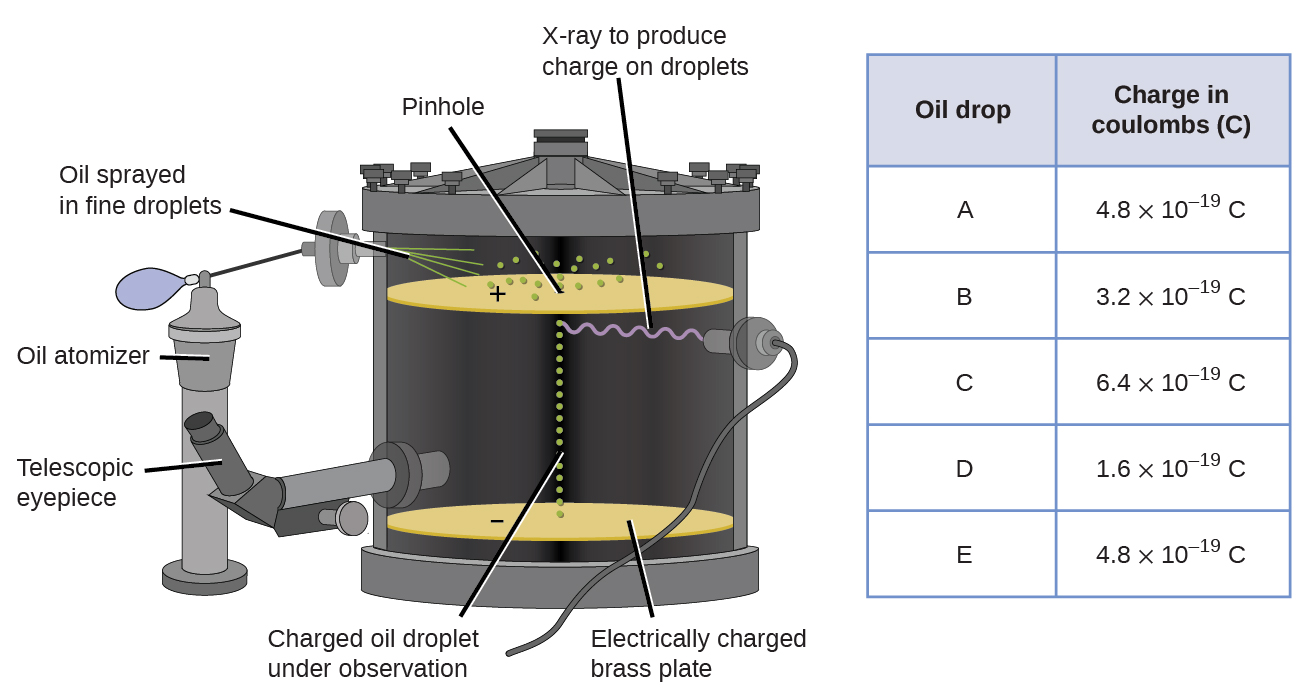
figuur \(\Paginindex{6}\): Millikan ‘ s experiment meet de lading van individuele oliedruppels. De getabelleerde gegevens zijn voorbeelden van een paar mogelijke waarden.
kijkend naar de ladingsgegevens die Millikan verzamelde, hebt u misschien herkend dat de lading van een oliedruppel altijd een veelvoud is van een specifieke lading, 1.6 \(\times\) 10-19 C. Millikan concludeerde dat deze waarde daarom een fundamentele lading moet zijn—de lading van een enkel elektron—met zijn gemeten ladingen als gevolg van een overmaat van één elektron (1 keer 1.6 \(\maal\) 10-19 C), twee elektronen (2 maal 1.6 \(\maal\) 10-19 C), drie elektronen (3 maal 1.6 \(\maal\) 10-19 C), enzovoort, op een gegeven oliedruppel. Aangezien de lading van een elektron nu bekend was door Millikan ’s onderzoek, en de lading-massa verhouding al bekend was door Thomson’ s onderzoek (1.759 \(\times\) 1011 C/kg), was er slechts een eenvoudige berekening nodig om ook de massa van het elektron te bepalen.
\
wetenschappers hadden nu vastgesteld dat het atoom niet ondeelbaar was zoals Dalton had gedacht, en door het werk van Thomson, Millikan en anderen, waren de lading en de massa van de negatieve, subatomaire deeltjes—de elektronen—bekend. Het positief geladen deel van een atoom werd echter nog niet goed begrepen. In 1904 stelde Thomson het “plum pudding” – model van atomen voor, dat een positief geladen massa beschreef met een gelijke hoeveelheid negatieve lading in de vorm van elektronen die erin zijn ingebed, aangezien alle atomen elektrisch neutraal zijn. Een concurrerend model werd in 1903 voorgesteld door Hantaro Nagaoka, die een Saturnus-achtig atoom postuleerde, bestaande uit een positief geladen bol omringd door een halo van elektronen (figuur \(\Paginindex{3}\)).
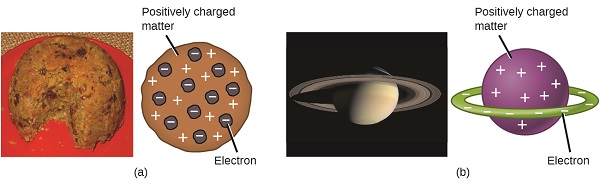
figuur \(\Paginindex{7}\): (a) Thomson suggereerde dat atomen leken op plum pudding, een Engels dessert bestaande uit vochtige cake met ingebedde rozijnen (“pruimen”). (b) Nagaoka stelde voor dat atomen leken op de planeet Saturnus, met een ring van elektronen rond een positieve “planeet.”(credit a: modification of work by”Man vyi” /Wikimedia Commons; credit b: modification of work by “NASA” / Wikimedia Commons).de volgende belangrijke ontwikkeling in het begrijpen van het atoom kwam van Ernest Rutherford, een natuurkundige uit Nieuw-Zeeland die zijn wetenschappelijke carrière grotendeels doorbracht in Canada en Engeland. Hij voerde een reeks experimenten uit met behulp van een bundel van zeer snelle, positief geladen alfa-deeltjes (α-deeltjes) die werden geproduceerd door het radioactieve verval van radium; α-deeltjes bestaan uit twee protonen en twee neutronen (meer informatie over radioactief verval vindt u in het hoofdstuk over nucleaire chemie). Rutherford en zijn collega ‘ s Hans Geiger (later bekend om de Geigerteller) en Ernest Marsden richtten een bundel van α-deeltjes, waarvan de bron in een loden blok was ingebed om het grootste deel van de straling te absorberen, op een zeer dun stuk goudfolie en onderzochten de resulterende verstrooiing van de α-deeltjes met behulp van een lichtgevend scherm dat kort gloeide waar geraakt door een α-deeltje.
wat hebben ze ontdekt? De meeste deeltjes gingen dwars door de folie zonder dat ze werden afgebogen. Sommige werden echter lichtjes omgeleid en een heel klein aantal werd bijna recht terug naar de bron afgebogen (figuur \(\Paginindex{4}\)). Rutherford beschreef het vinden van deze resultaten: “het was nogal de meest ongelooflijke gebeurtenis die me ooit is overkomen in mijn leven. Het was bijna net zo ongelooflijk alsof je een 15-inch schaal vuurde op een stuk zijdepapier en het kwam terug en raakte je ” 1 (p. 68).
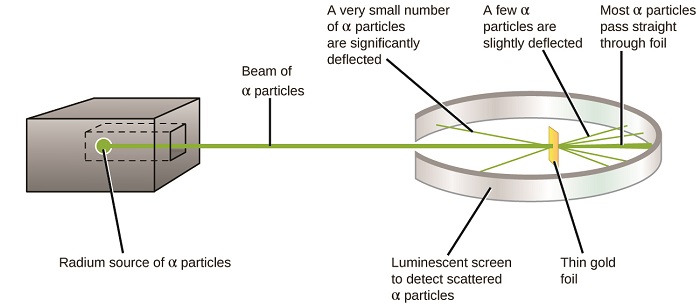
figuur \(\Paginindex{8}\): Geiger en Rutherford vuurden α-deeltjes af op een stuk goudfolie en detecteerden waar deze deeltjes heengingen, zoals blijkt uit dit schema van hun experiment. De meeste deeltjes gingen rechtstreeks door de folie, maar enkele werden licht afgebogen en een zeer klein aantal werd aanzienlijk afgebogen.
hier is wat Rutherford concludeerde: omdat de meeste snel bewegende α-deeltjes ongeëvenaard door de goudatomen gingen, moeten ze door een vrijwel lege ruimte in het atoom zijn gereisd. Alfadeeltjes zijn positief geladen, dus er ontstonden afbuigingen toen ze een andere positieve lading tegenkwamen (zoals ladingen elkaar afstoten). Omdat als ladingen elkaar afstoten, moeten de paar positief geladen deeltjes die abrupt van pad veranderden een ander lichaam hebben geraakt of dichtbij zijn gekomen dat ook een sterk geconcentreerde, positieve lading had. Aangezien de doorbuigingen een klein deel van de tijd plaatsvonden, nam deze lading slechts een klein deel van de ruimte in de goudfolie in beslag. Het analyseren van een reeks van dergelijke experimenten in detail, Rutherford trok twee conclusies:
- het volume dat door een atoom wordt ingenomen, moet bestaan uit een grote hoeveelheid lege ruimte.
- een klein, relatief zwaar, positief geladen lichaam, de kern, moet zich in het centrum van elk atoom bevinden.
deze analyse bracht Rutherford ertoe een model voor te stellen waarin een atoom bestaat uit een zeer kleine, positief geladen kern, waarin het grootste deel van de massa van het atoom geconcentreerd is, omgeven door negatief geladen elektronen, zodat het atoom elektrisch neutraal is (Figuur \(\Paginindex{5}\)).
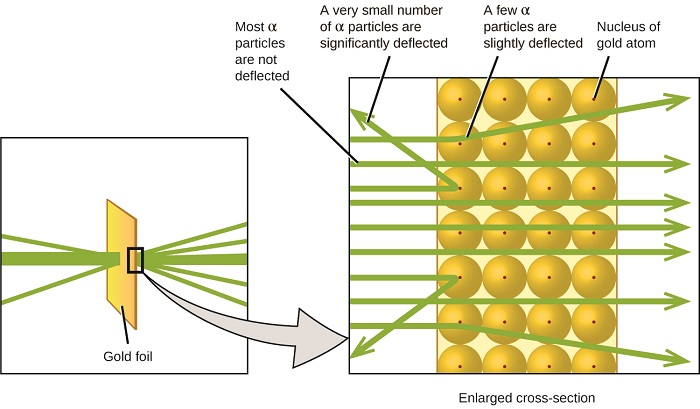
figuur \(\Paginindex{9}\): De α-deeltjes worden alleen afgebogen wanneer ze botsen met of dicht bij de veel zwaardere, positief geladen goudkern passeren. Omdat de kern zeer klein is in vergelijking met de grootte van een atoom, worden zeer weinig α-deeltjes afgebogen. De meeste gaan door het relatief grote gebied bezet door elektronen, die te licht zijn om de snel bewegende deeltjes af te buigen.na veel meer experimenten ontdekte Rutherford ook dat de kernen van andere elementen de waterstofkern bevatten als een “bouwsteen”, en hij noemde dit meer fundamentele deeltje het proton, het positief geladen subatomair deeltje dat in de kern wordt gevonden. Met één toevoeging, die je hierna zult leren, wordt dit nucleaire model van het atoom, dat meer dan een eeuw geleden werd voorgesteld, nog steeds gebruikt.
een andere belangrijke vondst was de ontdekking van isotopen. In de vroege jaren 1900 identificeerden wetenschappers verschillende stoffen die nieuwe elementen leken te zijn, ze te isoleren van radioactieve ertsen. Bijvoorbeeld, een” nieuw element ” geproduceerd door het radioactieve verval van thorium kreeg aanvankelijk de naam mesothorium. Een meer gedetailleerde analyse toonde echter aan dat mesothorium chemisch identiek was aan radium (een ander vervalproduct), ondanks het feit dat het een andere atoommassa had. Dit resultaat, samen met soortgelijke bevindingen voor andere elementen, leidde de Engelse chemicus Frederick Soddy tot het besef dat een element soorten atomen met verschillende massa ‘ s kon hebben die chemisch niet te onderscheiden waren. Deze verschillende types worden isotopen genoemd-atomen van hetzelfde element die in massa verschillen. Soddy kreeg in 1921 de Nobelprijs voor de Scheikunde voor deze ontdekking.
Eén puzzel bleef over: de kern bevatte bijna de gehele massa van een atoom, waarbij het aantal protonen slechts de helft of minder van die massa opleverde. Verschillende voorstellen werden gedaan om uit te leggen wat de resterende massa vormde, inclusief het bestaan van neutrale deeltjes in de kern. Zoals je zou verwachten, is het detecteren van niet-geladen deeltjes een hele uitdaging. pas in 1932 vond James Chadwick bewijs van neutronen, niet-geladen, subatomaire deeltjes met een massa die ongeveer gelijk is aan die van protonen. Het bestaan van de neutronen verklaart ook isotopen: ze verschillen in massa omdat ze verschillende aantallen neutronen hebben, maar ze zijn chemisch identiek omdat ze hetzelfde aantal protonen hebben. Dit zal later in deze eenheid meer in detail worden uitgelegd.