5.3: Lewis diagrammen
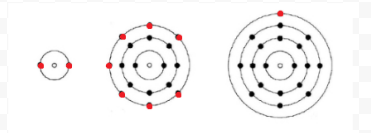
Lewis gebruikte eenvoudige diagrammen (nu Lewis diagrammen genoemd) om bij te houden hoeveel elektronen aanwezig waren in de buitenste, of valentie, schil van een bepaald atoom. De kern van het atoom, dat wil zeggen de kern samen met de binnenste elektronen, wordt vertegenwoordigd door het chemische symbool, en alleen de valentie-elektronen worden getekend als stippen rond het chemische symbool. Zo kunnen de drie atomen in Figuur 1 van elektronen en valentie worden weergegeven door de volgende Lewis diagrammen:

als het atoom een edelgasatoom is, zijn twee alternatieve procedures mogelijk. Of we kunnen het atoom beschouwen als nul valentie-elektronen of we kunnen de buitenste gevulde schil beschouwen als de valentieschil. De eerste drie edelgassen kunnen dus worden geschreven als:
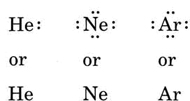
voorbeeld \(\Paginindex{1}\): Lewis Structures
teken Lewis diagrammen voor een atoom van elk van de volgende elementen: Li, N, f, Na
oplossing
We vinden uit het periodiek systeem binnen de voorkant dat Li een atoomnummer 3 heeft. Het bevat dus drie elektronen, één meer dan het edelgas He. Dit betekent dat de buitenste, of valentie, shell slechts één elektron bevat, en het Lewis diagram is
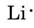
volgens dezelfde redenering heeft N zeven elektronen, vijf meer dan He, terwijl F negen elektronen heeft, zeven meer dan He, wat
![]()
Na heeft negen elektronen meer dan He, maar acht daarvan bevinden zich in de kern, wat overeenkomt met de acht elektronen in de buitenste schil van Ne. Aangezien Na slechts 1 elektron meer heeft dan Ne, is het Lewis-diagram
![]()
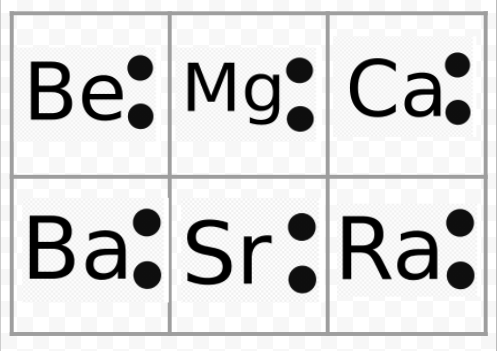
merk op dat de Lewis-diagrammen van de alkalimetalen identiek zijn, met uitzondering van hun chemische symbolen. Dit komt mooi overeen met het zeer vergelijkbaar chemisch gedrag van de alkalimetalen. Ook Lewis-diagrammen voor alle elementen in andere groepen, zoals de alkalische aarden of halogenen, zien er hetzelfde uit.
De Lewis-diagrammen kunnen ook worden gebruikt om de valenties van de elementen te voorspellen. Lewis suggereerde dat het aantal valenties van een atoom gelijk was aan het aantal elektronen in zijn valentieschil of aan het aantal elektronen dat zou moeten worden toegevoegd aan de valentieschil om de elektronische structuur van het volgende edelgas te bereiken. Als voorbeeld van dit idee, beschouw de elementen Be en O. hun Lewis diagrammen en die van de edelgassen He en Ne zijn

als we Be met He vergelijken, zien we dat de eerste nog twee elektronen heeft en daarom een valentie van 2 zou moeten hebben. Het element O zou een valentie van 6 of een valentie van 2 kunnen hebben omdat het zes valentie-elektronen heeft-twee minder dan Ne. Met behulp van regels van valentie ontwikkeld op deze manier, Lewis was in staat om de regelmatige toename en afname van de subscripten van de samenstellingen in de tabel gevonden in de valentie sectie, en hier gereproduceerd verklaren. Daarnaast kon hij meer dan 50 procent van de formules in de tabel voor zijn rekening nemen. (Degenen die het eens zijn met zijn ideeën zijn gearceerd in kleur in de tabel. U kunt nu naar die tabel verwijzen en controleren of sommige van de aangegeven formules de regels van Lewis volgen. Lewis ‘ succes in dit verband gaf een duidelijke indicatie dat elektronen de belangrijkste factor waren bij het bijeenhouden van atomen bij de vorming van moleculen.
ondanks deze successen zijn er ook moeilijkheden te vinden in Lewis’ theorieën, in het bijzonder voor elementen buiten calcium in het periodiek systeem. Het element Br (Z = 35), bijvoorbeeld, heeft 17 meer elektronen dan het edelgas Ar (Z = 18). Dit leidt ons tot de conclusie dat Br 17 valentie-elektronen heeft, wat het lastig maakt om uit te leggen waarom Br zo nauw op Cl en F lijkt, hoewel deze twee atomen slechts zeven valentie-elektronen hebben.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University Of Minnesota Rochester), Tim Wendorff, en Adam Hahn.