Chemistry for Non-Majors
Hoe verandert de energie van deze arbeider als hij op en neer de ladder klimt?
een ladder beklimmen kost energie. Bij elke stap duw je jezelf tegen de zwaartekracht en accumuleer je potentiële energie. Terug naar beneden komen maakt die potentiële energie vrij terwijl je stap voor stap afdaalt. Als je niet oppast, kun je die potentiële energie in één keer loslaten wanneer je van de ladder valt (nooit een goed idee). Daarnaast nemen we de klim of afdaling in stappen. Er is geen “tussen” positie op de ladder – je voet ofwel raakt een sport of het raakt lege ruimte en je bent in de problemen totdat je een sport om op te staan.

naar aanleiding van de ontdekkingen van waterstofemissiespectra en het foto-elektrisch effect, stelde de Deense natuurkundige Niels Bohr (1885-1962) in 1915 een nieuw model van het atoom voor. Bohr stelde voor dat elektronen geen energie uitstralen omdat ze om de kern draaien, maar bestaan in toestanden van constante energie die hij stationaire toestanden noemde. Dit betekent dat de elektronen op vaste afstanden van de kern draaien (zie figuur hieronder). Bohr ‘ s werk was voornamelijk gebaseerd op de emissiespectra van waterstof. Dit wordt ook wel het planetaire model van het atoom genoemd. Het verklaart de werking van het waterstofatoom. Bohr kreeg in 1922 de Nobelprijs voor de natuurkunde voor zijn werk.
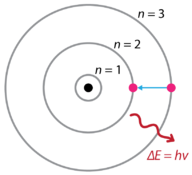
figuur 1. Bohr ‘ s atomaire model waterstof emissie spectra.
Bohr legde uit dat elektronen in verschillende banen kunnen worden verplaatst met de toevoeging van energie. Wanneer de energie wordt verwijderd, keren de elektronen terug naar hun grondtoestand, die een overeenkomstige hoeveelheid energie uitzendt – een kwantum van licht, of foton. Dit was de basis voor wat later bekend werd als de kwantumtheorie . Dit is een theorie gebaseerd op het principe dat materie en energie de eigenschappen hebben van zowel deeltjes als golven. Het is verantwoordelijk voor een breed scala aan fysische verschijnselen, waaronder het bestaan van afzonderlijke pakketten energie en materie, het onzekerheidsbeginsel en het uitsluitingsprincipe.
volgens het Bohr-model, vaak een planetair model genoemd, omringen de elektronen de kern van het atoom in specifieke toegestane banen die banen worden genoemd. Wanneer het elektron zich in een van deze banen bevindt, is zijn energie gefixeerd. De grondtoestand van het waterstofatoom, waar de energie het laagst is, is wanneer het elektron zich in de baan bevindt die het dichtst bij de kern ligt. De banen die verder van de kern verwijderd zijn, zijn allemaal van achtereenvolgens grotere energie. Het elektron mag geen ruimte innemen tussen de banen in. Een alledaagse analogie met het Bohr-model is de Sporten van een ladder. Als je een ladder op of af beweegt, kun je alleen specifieke sporten bezetten en mag je niet in de ruimtes tussen sporten zitten. Omhoog bewegen verhoogt je potentiële energie, terwijl omlaag bewegen je energie vermindert.Bohr ‘ s werk had een grote invloed op ons moderne begrip van de innerlijke werking van het atoom. Echter, zijn model werkte goed voor een verklaring voor de emissies van het waterstofatoom, maar was ernstig beperkt wanneer toegepast op andere atomen. Kort nadat Bohr zijn planetaire model van het atoom publiceerde, werden verschillende nieuwe ontdekkingen gedaan, wat resulteerde in, nogmaals, een herziene kijk op het atoom.
samenvatting
- het Bohr-model stelt dat elektronen rond de kern draaien op vaste energieniveaus.
- banen verder van de kern bestaan bij hogere energieniveaus.
- wanneer elektronen terugkeren naar een lager energieniveau, geven ze energie uit in de vorm van licht.
praktijk
Gebruik de link hieronder om de volgende vragen te beantwoorden:
- Hoe verandert een elektron Baan?
- waarop was het Bohr-model gebaseerd?
- Wat geloofde Bohr over de banen?
- werkt Bohr ‘ s model voor alle atomen?
Review
- Wanneer heeft Bohr zijn model van het atoom voorgesteld?
- Wat is een stationaire toestand?
- Wat is de grondtoestand?
- kan het elektron een ruimte tussen de banen innemen?
verklarende woordenlijst
- planetair model: een manier om Bohr ‘ s model van het atoom te beschrijven.
- kwantumtheorie: materie en energie hebben de eigenschappen van zowel deeltjes als golven.
- stationaire toestand: elektronen baan op vaste afstand van de kern.