Enthalpie en chemische reacties
7.3 enthalpie en chemische reacties
leerdoelstellingen
- definiëren enthalpie.
- geeft de enthalpie verandering van chemische reacties goed weer.
- leg uit hoe enthalpieveranderingen experimenteel worden gemeten.
nu we hebben aangetoond hoe energie, werk en warmte gerelateerd zijn, zijn we bereid om energieveranderingen in chemische reacties te overwegen. Een fundamenteel concept is dat elke chemische reactie plaatsvindt met een gelijktijdige verandering in energie. Nu moeten we leren hoe we deze energieveranderingen goed kunnen uitdrukken.uit ons onderzoek naar gassen in hoofdstuk 6 ” gassen “en onze definitie van werk in paragraaf 7.2″ werk en warmte ” blijkt dat omstandigheden als Druk, volume en temperatuur de energie-inhoud van een systeem beïnvloeden. Wat we nodig hebben is een definitie van energie die geldt wanneer sommige van deze voorwaarden worden gespecificeerd (enigszins vergelijkbaar met onze definitie van standaard temperatuur en druk in onze studie van gassen). We definiëren de enthalpieverandering de warmte van een proces bij constante druk; aangeduid ΔH. (ΔH) als de warmte van een proces wanneer de druk constant wordt gehouden:
ΔH≡qat constante druk
de letter H staat voor “enthalpie”, een soort energie, terwijl de Δ een verandering in de hoeveelheid impliceert. We zullen altijd geïnteresseerd zijn in de verandering in H, in plaats van de absolute waarde van H zelf.
wanneer een chemische reactie optreedt, is er een karakteristieke verandering in de enthalpie. De enthalpieverandering voor een reactie wordt typisch geschreven na een evenwichtige chemische vergelijking en op dezelfde lijn. Bijvoorbeeld, wanneer twee mol waterstof met één mol zuurstof reageren om twee mol water te maken, is de kenmerkende enthalpieverandering 570 kJ. We schrijven de vergelijking als
2H2(g) + O2(g) → 2H2O (J) ΔH = -570 kJ
een chemische vergelijking die een enthalpieverandering omvat wordt een thermochemische equationeen chemische vergelijking genoemd die een enthalpieverandering omvat.. Een thermochemische vergelijking wordt verondersteld te verwijzen naar de vergelijking in Molaire hoeveelheden, wat betekent dat het moet worden geïnterpreteerd in termen van mollen, niet individuele moleculen.
Voorbeeld 5
schrijf de thermochemische vergelijking voor de reactie van PCL3(g) met Cl2(g) om PCl5 (g) te maken, die een enthalpieverandering van -88 kJ heeft.
oplossing
de thermochemische vergelijking is
PCl3(g) + Cl2(g) → PCL5(g) ΔH = -88 kJ
Test jezelf
schrijf de thermochemische vergelijking voor de reactie van N2(g) met O2(g) om 2NO (g) te maken, die een enthalpieverandering van 181 kJ heeft.
antwoord
N2(g) + O2(g) → 2NO (g) ΔH = 181 kJ
u hebt misschien gemerkt dat de ΔH voor een chemische reactie positief of negatief kan zijn. Het getal wordt verondersteld positief te zijn als het geen teken heeft; een + teken kan expliciet worden toegevoegd om verwarring te voorkomen. Van een chemische reactie die een positieve ΔH heeft wordt gezegd dat het een endothermische chemische reactie is die een positieve verandering in de enthalpie heeft., terwijl een chemische reactie die een negatieve ΔH heeft wordt gezegd dat exothermicA chemische reactie die een negatieve verandering in enthalpie heeft..
wat betekent het als de ΔH van een proces positief is? Het betekent dat het systeem waarin de chemische reactie plaatsvindt energie wint. Als men de energie van een systeem beschouwt als een hoogte op een verticale energieplot, kan de enthalpie verandering die de reactie begeleidt worden weergegeven als in Deel (a) in Figuur 7.3 “reactie-energie”: de energie van de reagentia heeft enige energie, en het systeem verhoogt zijn energie als het gaat om producten. De producten zijn hoger op de verticale schaal dan de reagentia. Endotherme, dan, impliceert dat het systeem wint, of absorbeert, energie.
Er bestaat een tegengestelde situatie voor een exotherm proces, zoals getoond in Deel b) in Figuur 7.3 “reactie-energie”. Als de enthalpie verandering van een reactie negatief is, verliest het systeem energie, dus de producten hebben minder energie dan de reagentia, en de producten zijn lager op de verticale energieschaal dan de reagentia zijn. Exotherm betekent dan dat het systeem energie verliest of afgeeft.
figuur 7.3 Reactieenergie
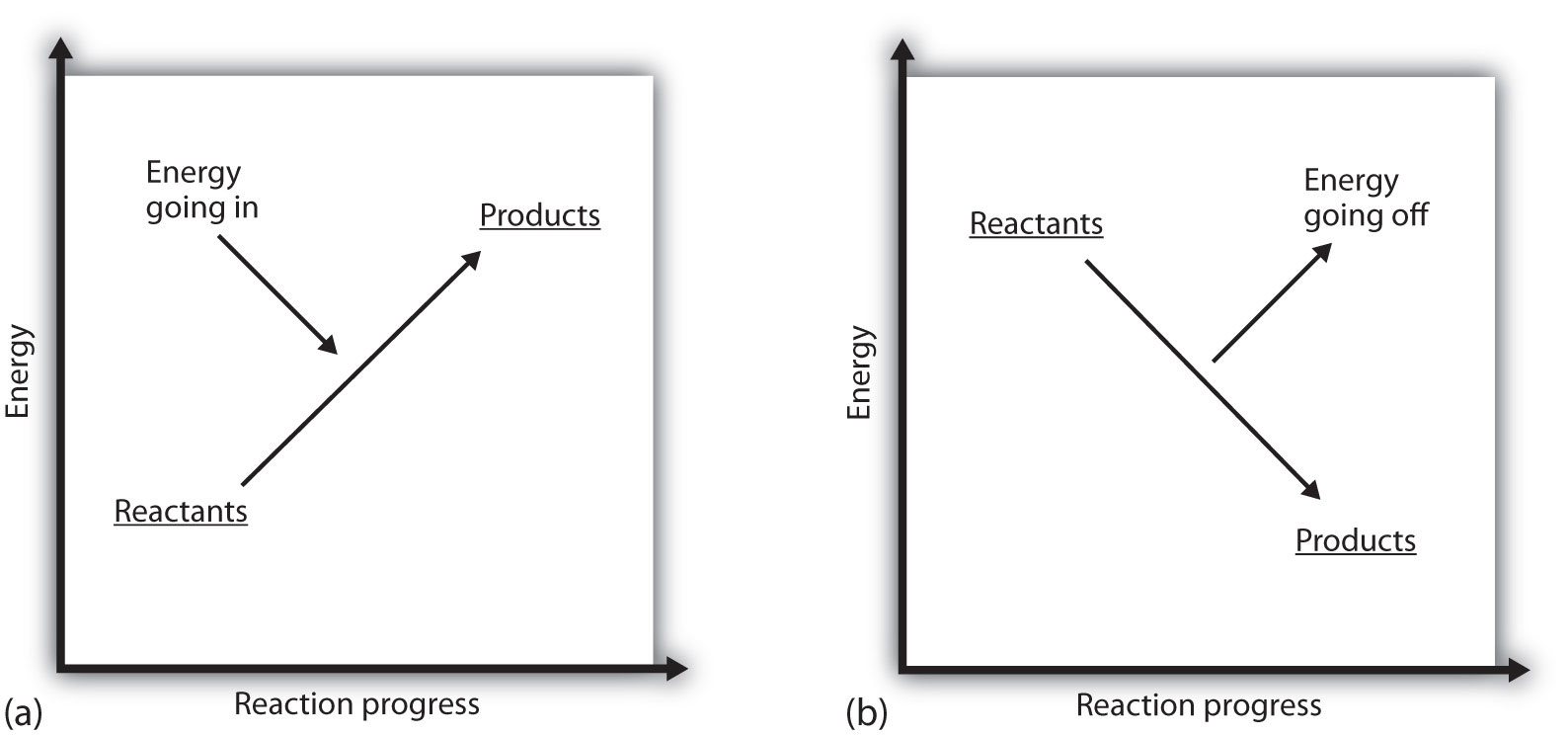
(a) Bij een endotherme reactie neemt de energie van het systeem toe (d.w.z. beweegt hoger op de verticale schaal van energie). (b) bij een exotherme reactie neemt de energie van het systeem af (d.w.z., beweegt lager op de verticale schaal van energie).
Voorbeeld 6
beschouw deze thermochemische vergelijking.
2CO(g) + O2(g) → 2CO2 (g) ΔH = -565 kJ
Is het exotherm of endotherm? Hoeveel energie wordt afgegeven of geabsorbeerd?
oplossing
per definitie is een chemische reactie met een negatieve ΔH exotherm, wat betekent dat zoveel energie—in dit geval 565 kJ—door de reactie wordt afgegeven.
Test uzelf
overweeg deze thermochemische vergelijking.
CO2(g) + H2(g) → CO(g) + H2O(g) ΔH = 42 kJ
Is het exotherm of endotherm? Hoeveel energie wordt afgegeven of geabsorbeerd?
antwoord
endotherm; 42 kJ worden geabsorbeerd.
Hoe worden ΔH-waarden experimenteel gemeten? In feite wordt ΔH niet gemeten; q wordt gemeten. Maar de metingen worden uitgevoerd onder omstandigheden van constante druk, dus ΔH is gelijk aan de gemeten q.
experimenteel wordt q gemeten door gebruik te maken van de vergelijking
q = mcΔT
We meten de massa van de chemische stoffen in een systeem. Dan laten we de chemische reactie optreden en meten we de verandering in temperatuur (ΔT) van het systeem. Als we de specifieke warmte van de materialen in het systeem kennen (meestal doen we dat), kunnen we q berekenen. die waarde van q is numeriek gelijk aan de ΔH van het proces, die we kunnen opschalen tot een Molaire schaal. De container waarin het systeem zich bevindt is meestal geïsoleerd, dus elke energieverandering gaat naar het veranderen van de temperatuur van het systeem, in plaats van te worden gelekt uit het systeem. De container wordt aangeduid als een calorimetera container gebruikt om de warmte van een chemische reactie te meten., en het proces van het meten van veranderingen in enthalpie wordt Calorimetry genoemd het proces van het meten van enthalpie veranderingen voor chemische reacties..
figuur 7.4 Calorimeters
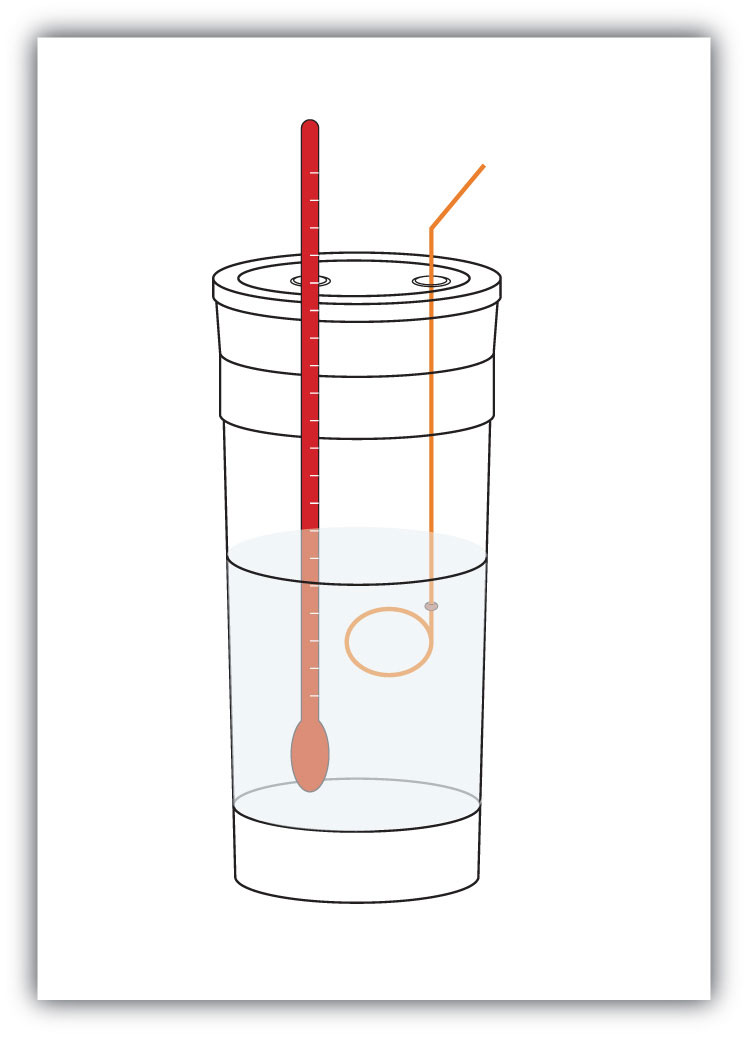
een eenvoudige calorimeter kan worden samengesteld uit enkele geneste koffiekopjes van schuim, een deksel, een thermometer en een roerder.
bijvoorbeeld, stel dat 4,0 g NaOH, of 0,10 mol NaOH, worden opgelost om 100,0 mL waterige oplossing te maken, terwijl 3,65 g HCl, of 0,10 mol HCl, worden opgelost om een andere 100,0 mL waterige oplossing te maken. De twee oplossingen worden gemengd in een geïsoleerde calorimeter, een thermometer wordt ingebracht en de calorimeter wordt afgedekt (zie figuur 7.4 “Calorimeter” voor een voorbeeld setup). De thermometer meet de temperatuurverandering als de volgende chemische reactie optreedt:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O (J)
een waarnemer merkt op dat de temperatuur stijgt van 22,4°C tot 29,1°C. aangenomen dat de warmtecapaciteiten en dichtheden van de oplossingen dezelfde zijn als die van zuiver water, hebben we nu de informatie die we nodig hebben om de enthalpieverandering van de chemische reactie te bepalen. De totale hoeveelheid oplossing is 200,0 mL en met een dichtheid van 1,00 g/mL hebben we dus 200,0 g oplossing. Met behulp van de vergelijking voor q vervangen we onze experimentele metingen en de soortelijke warmte van water (tabel 7.1 “specifieke warmte van verschillende stoffen”):
q=(200,0 g)(4.184 J G⋅°C)(6,7°C)
oplossend voor q, krijgen we
q=5.600 J δ ΔH voor de reactie
de warmte q is gelijk aan de ΔH voor de reactie omdat de chemische reactie plaatsvindt bij constante druk. Echter, de reactie geeft deze hoeveelheid energie af, dus het werkelijke teken op ΔH is negatief:
ΔH = -5.600 J voor de reactie
dus hebben we de volgende thermochemische vergelijking voor de chemische reactie die plaatsvond in de calorimeter:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(AQ)+110 H2o(ΔH)=-5.600 J
de 1/10 coëfficiënten zijn aanwezig om ons eraan te herinneren dat we begonnen met een tiende mol van elke reactant, dus we maken een tiende mol van elk product. Typisch, echter, rapporteren we thermochemische vergelijkingen in termen van mollen, niet een tiende van een mol. Om op te schalen naar Molaire hoeveelheden, moeten we de coëfficiënten vermenigvuldigen met 10. Maar als we dit doen, krijgen we 10 keer zoveel energie. Zo hebben we
NaOH (aq) + HCl(aq) → NaCl(AQ) + H2o(J) ΔH = -56.000 J
de ΔH kan worden omgezet in kj-eenheden, dus onze uiteindelijke thermochemische vergelijking is
NaOH (aq) + HCl(aq) → NaCl(aq) + H2o(J) ΔH = -56 kJ
We hebben zojuist onze experimentele gegevens uit calorimetrie genomen en de enthalpieverandering van een chemische reactie bepaald. Vergelijkbare metingen van andere chemische reacties kunnen de ΔH waarden bepalen van elke chemische reactie die je wilt bestuderen.
Voorbeeld 7
een 100 mL oplossing van 0.25 mol Ca2+(aq) werd gemengd met 0,50 mol F−(aq) ionen, en CaF2 werd neergeslagen:
Ca2+(aq) + 2F−(aq) → CaF2 (s)
De temperatuur van de oplossing nam toe met 10,5°C. Wat was de enthalpieverandering voor de chemische reactie? Wat was de enthalpie verandering voor de productie van 1 mol CaF2? Stel dat de oplossing dezelfde dichtheid en soortelijke warmte heeft als water.
oplossing
omdat we ΔT direct krijgen, kunnen we de warmte van de reactie bepalen, die gelijk is aan ΔH:
q=(100 g)(4.184 J g⋅°C) (10.5°C)
oplossend voor q, krijgen we
q = 4.400 J
daarom, ΔH = -4.400 J.
volgens de stoichiometrie van de reactie, zal precies 0,25 mol CaF2 vormen, dus deze hoeveelheid warmte is voor 0,25 mol. Voor 1 mol CaF2 moeten we de warmte met een factor vier opschalen:
q = 4.400 J × 4 = 17.600 J voor 1 mol CaF2
op Molaire basis is de verandering in enthalpie
ΔH = -17.600 J = -17.6 kJ
Test jezelf
in een calorimeter bij constante druk, 0,10 mol CH4(g) en 0,20 mol O2(g) worden gereageerd.
CH4(g) + 2O2 (g) → CO2 (g) + 2H2O (J)
de reactie verwarmt 750.0 g H2O bij 28,4°C. Wat is ΔH voor de reactie op een Molaire schaal?
antwoord
-891 kJ
Key Takeaways
- elke chemische reactie treedt op met een gelijktijdige verandering in energie.
- de verandering in enthalpie is gelijk aan warmte bij constante druk.
- Enthalpieveranderingen kunnen worden uitgedrukt met behulp van thermochemische vergelijkingen.
- Enthalpieveranderingen worden gemeten met behulp van calorimetrie.
oefeningen
-
onder welke omstandigheden zijn q en ΔH hetzelfde?
-
onder welke omstandigheden verschillen q en ΔH?
-
waterstofgas en chloorgas reageren om waterstofchloridegas te maken met een bijbehorende enthalpieverandering van -184 kJ. Schrijf een goed uitgebalanceerde thermochemische vergelijking voor dit proces.
-
propaan (C3H8) reageert met elementair zuurstofgas tot kooldioxide en vloeibaar water met een bijbehorende enthalpieverandering van -2.220 kJ. Schrijf een goed uitgebalanceerde thermochemische vergelijking voor dit proces.
-
stikstofgas reageert met zuurstofgas tot NO (g) terwijl het 180 kJ absorbeert. Schrijf een goed uitgebalanceerde thermochemische vergelijking voor dit proces.
-
vast natrium reageert met chloorgas om vast natriumchloride te maken en geeft 772 kJ af. Schrijf een goed uitgebalanceerde thermochemische vergelijking voor dit proces.
-
waterstofgas en chloorgas reageren om waterstofchloridegas te maken met een bijbehorende enthalpieverandering van -184 kJ. Is dit proces endotherm of exotherm?
-
propaan (C3H8) reageert met elementair zuurstofgas om kooldioxide te produceren en geeft 2.220 kJ Energie af. Is dit proces endotherm of exotherm?
-
stikstofgas reageert met zuurstofgas tot NO (g) terwijl het 180 kJ absorbeert. Is dit proces exotherm of endotherm?
-
natriummetaal kan met stikstof reageren tot natriumazide (NaN3) met een ΔH van 21,72 kJ. Is dit proces exotherm of endotherm?
-
teken een energiediagram voor de chemische reactie in oefening 8. (Zie figuur 7.3 “reactie-energie” voor een voorbeeld.)
-
teken een energiediagram voor de chemische reactie in oefening 9. (Zie figuur 7.3 “reactie-energie” voor een voorbeeld.)
-
in een oplossing van 250 mL worden 0,25 mol KOH(aq) en 0,25 mol HNO3(aq) gecombineerd. De temperatuur van de oplossing stijgt van 22,5°C tot 35,9°C. Stel dat de oplossing dezelfde dichtheid en warmtecapaciteit van water heeft. Wat is de hitte van de reactie, en wat is de ΔH van de reactie op Molaire basis?
-
in een 600 mL oplossing, 0.50 mol van Ca (OH)2 (aq) en 0,50 mol van H2SO4(aq) worden gecombineerd. De temperatuur van de oplossing stijgt met 22,3°C. Wat is de hitte van de reactie, en wat is de ΔH van de reactie op Molaire basis? Stel dat de oplossing dezelfde dichtheid en warmtecapaciteit van water heeft.
-
tot warm 400,0 g H2o, 0,050 mol ethanol (C2H5OH) wordt verbrand. Het water verwarmt van 24,6°C tot 65,6°C. Wat is de hitte van de reactie, en wat is de ΔH van de reactie op Molaire basis?
-
tot 100,0 g H2O warm wordt 0,066 mol bijenwas verbrand. Het water verwarmt van 21,4°C tot 25,5°C. Wat is de hitte van de reactie, en wat is de ΔH van de reactie op Molaire basis?
Antwoord
-
onder de voorwaarden van de constante druk
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exotherme
-
endotherme
-
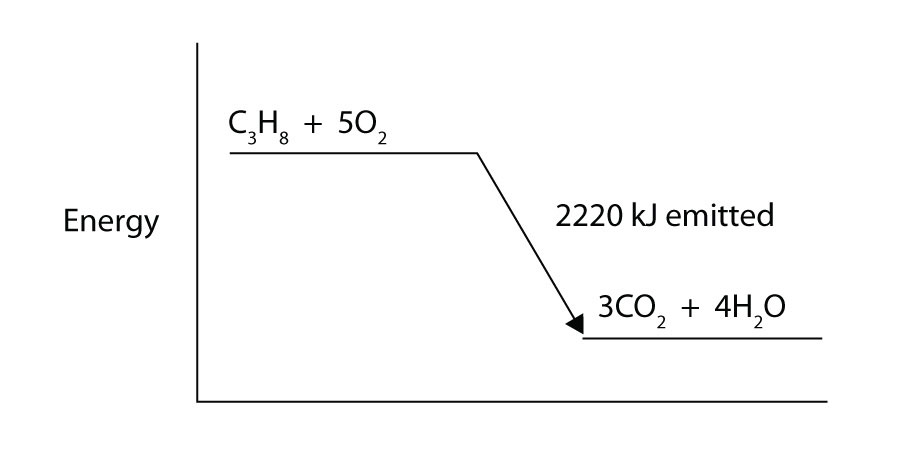
-
de warmte van de reactie = -14.0 kJ; ΔH = -56.0 kJ / mol reactanten
-
reactiewarmte = -68.6 kJ; ΔH = -1,370 kJ / mol ethanol