inleidende Scheikunde-1e Canadese editie
leerdoelen
- definieer buffer.
- identificeer de twee componenten van een buffer correct.
zoals aangegeven in Paragraaf 12.4 “sterke en zwakke zuren en basen en zouten daarvan”, komen zwakke zuren relatief vaak voor, zelfs in de voedingsmiddelen die we eten. Maar af en toe komen we een sterk zuur of base tegen, zoals maagzuur, dat een sterk zure pH van 1,7 heeft. Sterke zuren en basen kunnen per definitie een relatief grote hoeveelheid H+− of OH-ionen produceren en bijgevolg chemische activiteiten hebben. Bovendien kunnen zeer kleine hoeveelheden sterke zuren en basen de pH van een oplossing zeer snel veranderen. Als 1 mL maagzuur aan de bloedbaan werd toegevoegd en er geen correctiemechanisme aanwezig was, zou de pH van het bloed afnemen van ongeveer 7,4 tot ongeveer 4,7—een pH die niet bevorderlijk is voor het verder leven. Gelukkig heeft het lichaam een mechanisme om zulke dramatische pH-veranderingen te minimaliseren.
Het mechanisme omvat een buffer, een oplossing die bestand is tegen dramatische veranderingen in de pH. Buffers doen dit door te bestaan uit bepaalde paar opgeloste stoffen: ofwel een zwak zuur plus een zout afgeleid van dat zwakke zuur of een zwakke base plus een zout van die zwakke base. Een buffer kan bijvoorbeeld bestaan uit opgeloste HC2H3O2 (een zwak zuur) en NaC2H3O2 (het zout afgeleid van dat zwakke zuur). Een ander voorbeeld van een buffer is een oplossing die NH3 (een zwakke base) en NH4Cl (een zout afgeleid van die zwakke base) bevat.
laten we een HC2H3O2/NaC2H3O2 buffer gebruiken om aan te tonen hoe buffers werken. Als een sterke base−een bron van OH—(aq) ionen− aan de bufferoplossing wordt toegevoegd, zullen die OH-ionen reageren met HC2H3O2 in een zuur−base reactie:
HC2H3O2(aq) + OH−(AQ) → H2o(J) + c2h3o2− (AQ)
in plaats van de pH dramatisch te veranderen door de oplossing basisch te maken, reageren de toegevoegde OH-ionen om H2O te maken, zodat de pH niet veel verandert.
als een sterk zuur—een bron van H+—ionen-aan de bufferoplossing wordt toegevoegd, zullen de H+ – ionen reageren met het anion uit het zout. Omdat HC2H3O2 een zwak zuur is, wordt het niet veel geïoniseerd. Dit betekent dat als veel H + – ionen en C2H3O2− ionen aanwezig zijn in dezelfde oplossing, ze samen zullen komen om HC2H3O2 te maken:
H+(aq) + C2H3O2−(aq) → HC2H3O2(aq)
in plaats van de pH dramatisch te veranderen en de oplossing zuur te maken, reageren de toegevoegde H+ – ionen om moleculen van een zwak zuur te maken. Figuur 12.2″ de acties van Buffers ” illustreert beide acties van een buffer.
figuur 12.2 de acties van Buffers
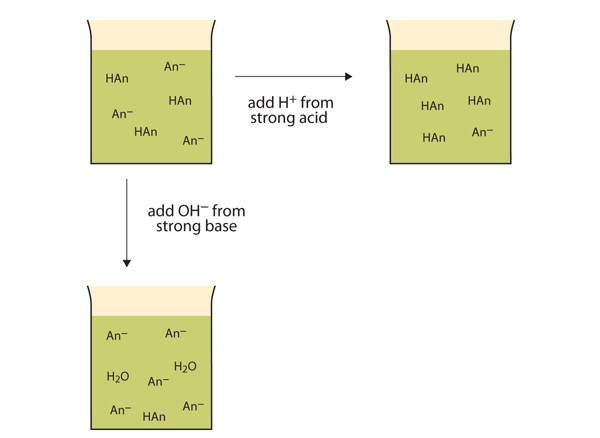
Buffers kunnen reageren met zowel sterke zuren (top) als sterke basen (side) om grote veranderingen in pH te minimaliseren.
Buffers gemaakt van zwakke basen en zouten van zwakke basen werken op dezelfde manier. Bijvoorbeeld, in een buffer met NH3 en NH4Cl, NH3 moleculen kunnen reageren met een overmaat H+ – ionen geïntroduceerd door sterke zuren:
NH3(aq) + H+(aq) → NH4+(aq)
tijdens de NH4+(aq) ionen kunnen reageren met de OH− ionen geïntroduceerd door sterke basen:
NH4+(aq) + OH−(aq) → NH3(aq) + H2O(ℓ)
Voorbeeld 15
Welke combinaties van stoffen kan een buffer oplossing?
- HCHO2 en NaCHO2
- HCl en NaCl
- CH3NH2 en CH3NH3Cl
- NH3 en NaOH
oplossing
- Hcho2 is mierenzuur, een zwak zuur, terwijl NaCHO2 het zout is dat wordt gemaakt uit het anion van het zwakke zuur (het formiaation ). De combinatie van deze twee opgeloste stoffen zou een bufferoplossing vormen.
- HCl is een sterk zuur, geen zwak zuur, dus de combinatie van deze twee opgeloste stoffen zou geen bufferoplossing vormen.
- CH3NH2 is methylamine, dat is als NH3 met een van de H-atomen gesubstitueerd door een CH3-groep. Omdat het niet is opgenomen in Tabel 12.2 “Sterke zuren en basen”, kunnen we aannemen dat het een zwakke base. De verbinding CH3NH3Cl is een zout gemaakt van die zwakke base, dus de combinatie van deze twee opgeloste stoffen zou een bufferoplossing maken.
- NH3 is een zwakke base, maar NaOH is een sterke base. De combinatie van deze twee opgeloste stoffen zou geen bufferoplossing vormen.
Test uzelf
welke combinaties van verbindingen kunnen een bufferoplossing maken?
- NaHCO3 en NaCl
- H3PO4 en NaH2PO4
- NH3 en (NH4)3PO4
- NaOH en NaCl
antwoorden
- Nee
- ja
- ja
- Nee
buffers werken alleen goed voor beperkte hoeveelheden toegevoegd sterk zuur of Base. Zodra een van beide opgeloste stoffen volledig reageert, is de oplossing niet langer een buffer en kunnen snelle veranderingen in pH optreden. We zeggen dat een buffer een bepaalde capaciteit heeft. Buffers die meer opgeloste stof in hen om te beginnen hebben grotere capaciteiten, zoals zou worden verwacht.
menselijk bloed heeft een buffersysteem om extreme veranderingen in de pH te minimaliseren. Eén buffer in het bloed is gebaseerd op de aanwezigheid van HCO3− en H2CO3 . Met deze buffer aanwezig, zelfs als sommige maagzuur zou zijn weg vinden rechtstreeks in de bloedbaan, de verandering in de pH van het bloed zou minimaal zijn. Binnen veel van de cellen van het lichaam, is er een buffersysteem dat op fosfaationen wordt gebaseerd.
App voor eten en drinken: Het zuur dat pijn verlicht
hoewel geneesmiddelen niet precies “voedsel en drank” zijn, nemen we ze wel in, dus laten we eens kijken naar een zuur dat waarschijnlijk het meest voorkomende geneesmiddel is: acetylsalicylzuur, ook wel bekend als aspirine. Aspirine staat bekend als pijnstiller en koortswerend (koortsreductiemiddel).
de structuur van aspirine wordt weergegeven in de bijgevoegde figuur. Het zuur deel is omcirkeld; het is het H-atoom in dat deel dat kan worden gedoneerd als aspirine werkt als een Brønsted-Lowry zuur. Omdat het niet wordt vermeld in Tabel 12.2 “sterke zuren en basen”, is acetylsalicylzuur een zwak zuur. Echter, het is nog steeds een zuur, en gezien het feit dat sommige mensen consumeren relatief grote hoeveelheden aspirine dagelijks, zijn zure aard kan problemen in de maagwand veroorzaken, ondanks de afweer van de maag tegen zijn eigen maagzuur.
figuur 12.3 de moleculaire structuur van aspirine

de omcirkelde atomen zijn het zure deel van het molecuul.
omdat de zure eigenschappen van aspirine problematisch kunnen zijn, bieden veel aspirinemerken een “gebufferde aspirine” vorm van het geneesmiddel aan. In deze gevallen bevat de aspirine ook een buffermiddel-meestal MgO-dat de zuurgraad van de aspirine regelt om de zure bijwerkingen te minimaliseren.
zo nuttig en gebruikelijk als aspirine is, werd het formeel op de markt gebracht als een geneesmiddel vanaf 1899. De Amerikaanse Food and Drug Administration( FDA), het overheidsagentschap belast met het toezicht op en de goedkeuring van drugs in de Verenigde Staten, werd pas in 1906 opgericht. Sommigen hebben betoogd dat als de FDA was gevormd voordat aspirine werd geïntroduceerd, aspirine nooit goedkeuring hebben gekregen vanwege zijn potentieel voor bijwerkingen—gastro-intestinale bloeden, piepen in de oren, het syndroom van Reye (een leverprobleem), en sommige allergische reacties. Echter, onlangs aspirine is aangeprezen voor zijn effecten in het verminderen van hartaanvallen en beroertes, dus het is waarschijnlijk dat aspirine is hier om te blijven.
Key Takeaways
- Een buffer is een oplossing die bestand is tegen plotselinge veranderingen in pH.
oefeningen
-
definieer buffer. Welke twee verwante chemische componenten zijn nodig om een buffer te maken?
-
kan een buffer worden gemaakt door een sterk zuur met een sterke base te combineren? Waarom of waarom niet?
-
welke combinaties van verbindingen kunnen een buffer maken? Neem waterige oplossingen aan.
a) HCl en NaCl
b) HNO2 en NaNO2
c) NH4NO3 en HNO3
d) NH4NO3 en NH3
4. Welke combinaties van verbindingen kunnen een buffer maken? Neem waterige oplossingen aan.
a) H3PO4 en Na3PO4
b) NaHCO3 en Na2CO3
c)NaNO3 en Ca(NO3) 2
d) HN3 en NH3
5. Voor elke combinatie in Oefening 3 die een buffer is, schrijf de chemische vergelijkingen voor de reacties van de buffercomponenten wanneer een sterk zuur en een sterke base worden toegevoegd.
6. Voor elke combinatie in Oefening 4 die een buffer is, schrijf de chemische vergelijkingen voor de reacties van de buffercomponenten wanneer een sterk zuur en een sterke base worden toegevoegd.
7. Het volledige fosfaatbuffersysteem is gebaseerd op vier stoffen: H3PO4, H2PO4 -, HPO42-en PO43 -. Welke verschillende bufferoplossingen kunnen van deze stoffen worden gemaakt?
8. Leg uit waarom NaBr geen component kan zijn in een zure of een basische buffer.
9. Er worden twee oplossingen gemaakt die dezelfde concentraties van opgeloste stoffen bevatten. De ene oplossing bestaat uit H3PO4 en Na3PO4, de andere uit HCN en NaCN. Welke oplossing moet de grotere capaciteit als buffer hebben?
10. Er worden twee oplossingen gemaakt die dezelfde concentraties van opgeloste stoffen bevatten. De ene oplossing bestaat uit NH3 en NH4NO3, terwijl de andere bestaat uit H2SO4 en Na2SO4. Welke oplossing moet de grotere capaciteit als buffer hebben?
antwoorden
een buffer is de combinatie van een zwak zuur of base en een zout van dat zwakke zuur of base.
a) no
b) yes
c) no
d) yes
3b: sterk zuur: NO2− + H+ → HNO2; sterke base: HNO2 + OH− → NO2− + H2O; 3d: sterke base: NH4+ + OH− → NH3 + H2O; sterk zuur: NH3 + h+ → NH4+7.
Buffers kunnen uit drie combinaties worden gemaakt: (1) H3PO4 en H2Po4−, (2) H2PO4− en HPO42−, en (3) HPO42− en PO43−. (Technisch, een buffer kan worden gemaakt van om het even welke twee componenten.)
De fosfaatbuffer moet de grotere capaciteit hebben.