Introduction Chemistry-1st Canadian Edition
Learning Objectives
- Definieer de dampspanning van vloeistoffen.
- verklaar de oorsprong van zowel de oppervlaktespanning als de capillaire werking.
Er zijn enkele eigenschappen die alle vloeistoffen hebben. De vloeistof die we het meest kennen is waarschijnlijk water, en het heeft deze eigenschappen. Andere vloeistoffen hebben ze ook, dat is iets om in gedachten te houden.
alle vloeistoffen hebben een bepaald deel van hun deeltjes dat voldoende energie heeft om de gasfase in te gaan, en als deze deeltjes zich aan het oppervlak van de vloeistof bevinden, doen ze dat (Figuur 10.6 “verdamping”). De vorming van een gas uit een vloeistof bij temperaturen onder het kookpunt wordt verdamping genoemd. Bij deze temperaturen wordt het materiaal in de gasfase damp genoemd, in plaats van gas; de term gas is gereserveerd voor wanneer de gasfase de stabiele fase is.
Figuur 10.6 Evapouration
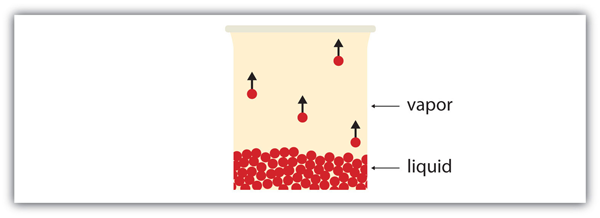
sommige deeltjes van een vloeistof hebben voldoende energie om uit de vloeibare fase te ontsnappen en een damp te worden.
als het beschikbare volume groot genoeg is, zal uiteindelijk alle vloeistof damp worden. Maar als het beschikbare volume niet voldoende is, zullen uiteindelijk een aantal van de dampdeeltjes de vloeibare fase terugkeren (figuur 10.7 “evenwicht”). Op een gegeven moment zal het aantal deeltjes dat de dampfase ingaat gelijk zijn aan het aantal deeltjes dat de dampfase verlaat, zodat er geen netto verandering is in de hoeveelheid damp in het systeem. We zeggen dat het systeem in evenwicht is. De partiële druk van de damp bij evenwicht wordt de dampspanning van de vloeistof genoemd.
figuur 10.7 evenwicht

op een gegeven moment wordt het aantal deeltjes dat de dampfase ingaat in evenwicht gebracht door het aantal deeltjes dat naar de vloeistof terugkeert. Dit punt heet evenwicht.
begrijp dat de vloeistof niet is gestopt met verdampen. Het omgekeerde proces—condensatie-vindt net zo snel plaats als de verdamping, zodat er geen nettoverandering in de hoeveelheid damp in het systeem optreedt. De term dynamisch evenwicht vertegenwoordigt een situatie waarin een proces nog steeds plaatsvindt, maar het tegenovergestelde proces gebeurt ook in hetzelfde tempo, zodat er geen netto verandering in het systeem.
de dampspanning van een stof is afhankelijk van de temperatuur van de stof; naarmate de temperatuur stijgt, neemt ook de dampspanning toe. Figuur 10.8 “grafieken van Dampdruk versus temperatuur voor verscheidene vloeistoffen” is een grafiek van dampdruk versus temperatuur voor verscheidene vloeistoffen. Na een bepaalde dampspanning kunnen we ook het kookpunt van een vloeistof herdefiniëren: de temperatuur waarbij de dampspanning van een vloeistof gelijk is aan de omgevingsdruk. De normale dampspanning is dus de temperatuur waarbij de dampspanning 760 torr is, of precies 1 atm. Kookpunten variëren dus met de omringende druk, een feit dat grote gevolgen kan hebben voor het koken van voedsel op lagere of hoger dan normale verhogingen. De atmosferische druk varieert aanzienlijk met de hoogte.
figuur 10.8 Plots van Dampdruk versus temperatuur voor verscheidene vloeistoffen
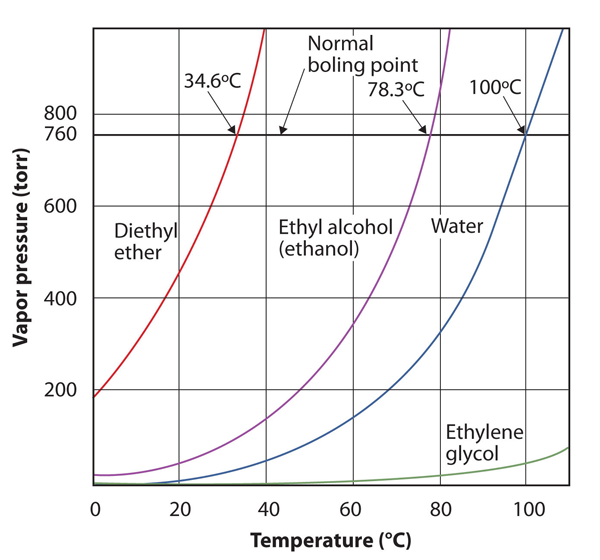
de dampspanning van een vloeistof hangt af van de identiteit van de vloeistof en de temperatuur, zoals deze grafiek laat zien.
Voorbeeld 4
gebruik figuur 10.8 “Plots van Dampdruk versus temperatuur voor verscheidene vloeistoffen” om het kookpunt van water te schatten op 500 torr, wat de geschatte Atmosferische druk is op de top van de Mount Everest.
oplossing
zie de begeleidende figuur. Vijfhonderd torr is tussen 400 en 600, dus we breiden een lijn uit van dat punt op de y-as naar de kromme voor water en laten het dan zakken naar de x-as om de bijbehorende temperatuur te lezen. Het lijkt erop dat het punt op de waterdampspanningscurve overeenkomt met een temperatuur van ongeveer 90°C, dus we concluderen dat het kookpunt van water bij 500 torr 90°C is.
figuur 10.9 met behulp van Figuur 10.8 “Plots van Dampdruk versus temperatuur voor meerdere vloeistoffen”om Voorbeeld 4
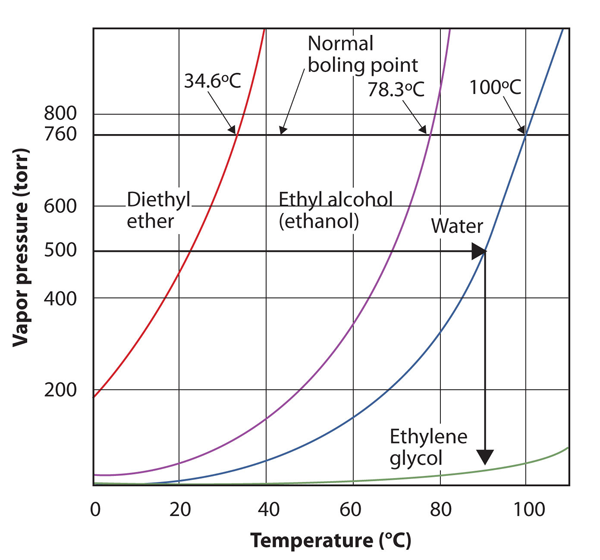
door de grafiek goed te lezen, kunt u het kookpunt van een vloeistof bij verschillende temperaturen schatten.
Test uzelf
gebruik figuur 10.8 “Plots van Dampdruk versus temperatuur voor verscheidene vloeistoffen” om het kookpunt van ethanol op 400 torr te schatten.
antwoord
ongeveer 65°c
De dampspanningscurve voor water is niet precies nul bij het smeltpunt-0°C. zelfs ijs heeft een dampspanning; daarom sublimeert het na verloop van tijd. De dampspanning van vaste stoffen is echter doorgaans veel lager dan die van vloeistoffen. Bij -1°C bedraagt de dampspanning van ijs 4,2 torr. Bij een vriestemperatuur van 0°F (-17°C) bedraagt de dampspanning van ijs slechts 1,0 torr; zogenaamde diepvriezers kunnen dalen tot -23°C, waarbij de dampspanning van ijs slechts 0,6 torr bedraagt.
Fasediagrammen
een fasediagram is een grafische weergave van de evenwichtsverhoudingen die bestaan tussen de fasen van een stof onder gespecificeerde druk en temperatuur (figuur 10.10). Het fasediagram is een combinatie van drie curven: de dampspanningscurve, de smeltkromme en de sublimatiecurve. We hebben eerder gezien dat dampspanningskrommen het evenwicht tussen de vloeistof-en gasfase vertegenwoordigen, en het punt waarop de druk gelijk is aan 1 atm is het normale kookpunt. Een extra kenmerk van deze curve in het fasediagram (groen), is dat het eindigt op het kritieke punt. Het kritieke punt is het punt bij de hoogste temperatuur en druk waarbij vloeistoffen en gassen onderscheiden blijven. Bij temperaturen en druk voorbij dit punt bestaat de kwestie in een fase met eigenschappen van zowel vloeistoffen als gassen die als superkritische vloeistof worden bekend.
De smeltkromme (oranje) vertegenwoordigt het evenwicht tussen vaste en vloeibare stof, en het punt waarop de druk gelijk is aan 1 atm is het normale smeltpunt. De sublimatiekromme (blauw) vertegenwoordigt het evenwicht dat bestaat tussen vast en gas. Tot slot staat het punt waar alle drie de krommen samenkomen bekend als het drievoudige punt. Op dit punt bestaan drie fasen (vast, vloeibaar en gas) bij evenwicht.
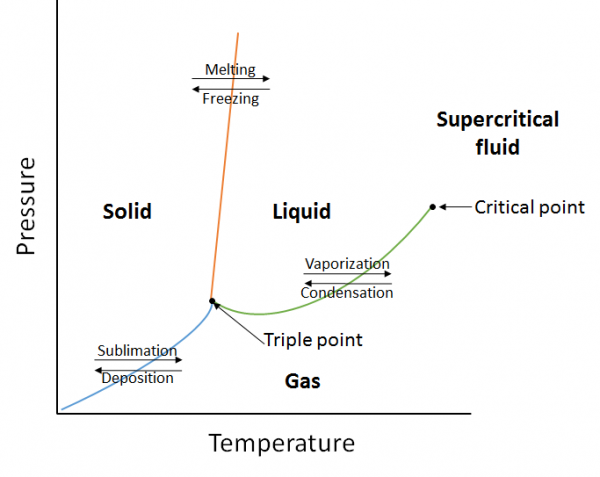
voorbeeld:
Bepaal met behulp van het volgende fase diagram wat er zou gebeuren als:
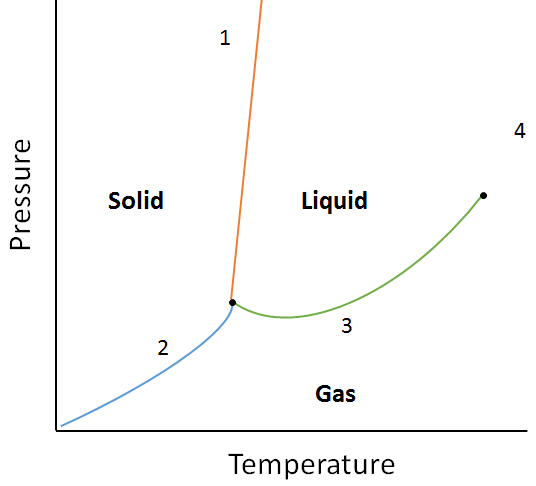
a. de temperatuur wordt verhoogd voor materie op punt 1.
b. de druk wordt verhoogd voor materie op punt 3.
oplossing:
a. materie op punt 1 zal smelten (fase veranderen van vast naar vloeibaar) als de temperatuur wordt verhoogd.
b. Materie op punt 3 zal condenseren (fase veranderen van gas naar vloeistof) als de temperatuur wordt verhoogd.
oppervlaktespanning en capillaire werking
alle vloeistoffen hebben ook enkele andere eigenschappen. Oppervlaktespanning is een effect veroorzaakt door een onbalans van krachten op de atomen aan het oppervlak van een vloeistof, zoals weergegeven in Figuur 10.11 “oppervlaktespanning”. Het blauwe deeltje in het grootste deel van de vloeistof ervaart intermoleculaire krachten van rondom, zoals geïllustreerd door de pijlen. Het gele deeltje op het oppervlak ervaart echter geen krachten erboven omdat er geen deeltjes boven zijn. Dit leidt tot een onbalans van krachten die we oppervlaktespanning noemen.
figuur 10.11 oppervlaktespanning

oppervlaktespanning komt voort uit het feit dat deeltjes aan het oppervlak van een vloeistof geen interacties van alle richtingen ervaren, wat leidt tot een onbalans van krachten aan het oppervlak.
figuur 10.12 effecten van de oppervlaktespanning
