kijk naar de recente artikelen
Abstract
hartfalen met een laag uitgangsvermogen (LoHF) is een zeldzame vorm van hartfalen (HF), maar een die zeer geavanceerde HF signaleert. Het wordt geassocieerd met onheilspellende prognose evenals aanzienlijke morbiditeit en mortaliteit. Echter, LoHF blijft grotendeels onder-onderzoek. De traditionele beschrijving van HF was gericht op congestief hartfalen (CHF), gekenmerkt door een laag hartminuutvolume en gepaard gaande met pulmonale/perifere congestie. Deze focus droeg bij tot onderwaardering van LoHF-patiënten die weinig of geen bewijs van congestie hebben. Bovendien hebben LoHF-patiënten geen bewezen therapie en hangt de keuze van de juiste behandeling af van de individuele pathofysiologie en de onderliggende etiologie. LoHF-patiënten hebben heterogene etiologie en pathofysiologie die het belang benadrukken van een diepgaand begrip van de klinische kenmerken, diagnose en klinische behandeling, die de basis vormen van dit overzicht.
sleutelwoorden
low-output cardiac syndrome, low-output heart failure, low-output state
Inleiding
ondanks opmerkelijke vooruitgang in medische en chirurgische therapieën blijft effectieve behandeling van hartfalen (HF) significante uitdagingen voor zorgverleners vormen. De uitdaging wordt weerspiegeld door de hoge percentages van HF-gerelateerde ziekenhuisopnames samen met verhoogde mortaliteit en morbiditeit . Een deel van de uitdaging is zeer heterogene etiologie, pathofysiologie en klinische presentaties van verschillende vormen van HF, waarin sommige HF-vormen een gebrek aan klinische onderzoeksgegevens en bijgevolg een beperkt begrip hebben. In het bijzonder is de traditionele beschrijving van HF bijna synoniem geweest met congestief hartfalen (CHF), maar de term CHF sluit een minderheid van HF-patiënten uit die weinig of geen aantoonbare symptomen van pulmonale en/of perifere congestie hebben . Low-output HF (LoHF) is ook gekoppeld aan een onheilspellende prognose en signaleert zeer geavanceerde HF. Bovendien ondersteunen symptomatische en pathofysiologische verschillen in CHF en LoHF de behoefte aan verschillende klinische behandelingsbenaderingen . Ondanks deze verschillen, zijn de traditionele HF therapieën gegeneraliseerd aan alle vormen van HF met inbegrip van CHF en LoHF, het creëren van een klinische behoefte om de pathofysiologie, diagnose en klinisch beheer van LoHF te begrijpen. In dit artikel verzamelen we gepubliceerd bewijs over LoHF in termen van epidemiologie, etiologie, pathofysiologie, diagnose en klinisch beheer. De bedoeling is om de kennis van de klinische status van LoHF te vernieuwen en de klinische behandeling van HF in het algemeen te verbeteren.
definitie
hartfalen is een complex klinisch syndroom gekenmerkt door structurele en / of functionele myocardiale defecten die leiden tot verminderde ventrikelvulling of ejectie . De complexiteit van het syndroom is duidelijk in zijn heterogene classificaties: rechts -, links-of bi-ventriculair op basis van defectlocatie; acuut of chronisch op basis van het begintijdstip; behouden, borderline of verminderde ejectiefractie op basis van functionele status; lage of hoge output op basis van cardiale output (CO), en voorwaartse of achterwaartse storing op basis van de richting van de bloedstroom. Elk van deze classificaties is significant voor de diagnose en behandeling van HF . Ondanks de verschillende classificaties wordt de term CHF traditioneel door elkaar gebruikt met HF, maar die LoHF onvoldoende beschrijft vanwege verschillende symptomatische en pathofysiologische verschillen.
LoHF, ook bekend als low CO in acute gedecompenseerde HF, beschrijft een hoge-scherpte vorm van HF gekarakteriseerd door verminderde forward CO (cardiale index < 2.0 L/min/m2 en systolische bloeddruk < 90 mmHg) en endorgaanhypoperfusie met weinig of geen bewijs van pulmonale congestie . LoHF onderscheidt zich van CHF, dat HF beschrijft die gekenmerkt wordt door verminderde CO, waardoor pulmonale en perifere congestie ontstaat, wat respectievelijk leidt tot dyspneu en perifeer oedeem . De 2005 European Society of Cardiology (ESC) guidelines on diagnostic and management of HF suggereren een continuüm van low cardiac output syndrome (LCOS) tot LoHF tot cardiogene shock. De ESC-richtlijnen definiëren cardiogene shock als bewijs van weefselperfusie geïnduceerd door HF na correctie van pre-load gekarakteriseerd door systolische BP < 90 mmHg of een daling van de gemiddelde arteriële druk > 30 mmHg; urineproductie < 0,5 ml/kg/u; polsslag > 60 slagen per minuut (bpm) met of zonder aanwijzingen voor congestie . LCOS aan de andere kant is gebruikelijk bij post-operatieve HF-patiënten en gedefinieerd als de behoefte aan post-operatieve intra-aorta ballonpomp of inotrope ondersteuning gedurende meer dan 30 minuten in een acute zorg setting .
Epidemiologie
de exacte prevalentie en incidentie van LoHF in de algemene populatie is volledig onbekend. Momenteel zijn er geen epidemiologische gegevens op basis van populaties die specifiek zijn voor LoHF. De enige beschikbare gegevens zijn afkomstig van klinische onderzoeken in één centrum waarbij een geselecteerde populatie HF-patiënten werd onderzocht die een hartoperatie hebben ondergaan. In 1975, Parr et al. maakte de rudimentaire beschrijving van de klinische entiteit van LCOS en rapporteerde een incidentie van 25% bij kinderen die een hartoperatie hadden ondergaan op basis van verminderde CO gedefinieerd als CI < 2,0 L/min/m2. Twee decennia later, Wernovsky et al. vertoonde dezelfde incidentie van postoperatieve LCOS bij patiënten die een arteriële switchoperatie hadden ondergaan die binnen 6-18 uur na de operatie optrad. Veel recente klinische studies melden een grote variatie in prevalentie, van 3,6% (mannen) en 5,9% (vrouwen) tot 9,1% en tot 41% en een incidentie van 14,7% . In een recente lange termijn (twintig jaar: 1990-2009) prospectieve klinische studie met 25.176 consecutieve coronaire bypass graft (CABG) operatiepatiënten, Algarni et al. de prevalentie van postoperatieve LCO ‘ s daalde significant van 9,1% (1990-1994) tot 2,4% (2005-2009) .
etiologie
de etiologie van LoHF is multifactorieel. Over het algemeen is het een gevolg van disfunctie van de linker ventrikel (LV), de rechter ventrikel (RV) of de systemische ventrikel (enkel ventrikel anatomie) en kan zowel systolische als/of diastolische disfunctie omvatten . Verstoringen in ventriculaire vulling of uitwerpen leiden tot LoHF, wat een frequente complicatie is bij patiënten die een hartoperatie hebben ondergaan of in cardiogene shock zijn . Het kan zich voordoen als een acute verslechtering bij patiënten met chronische HF of het kan een voorbijgaande en reversibele episode zijn met verdwijning van de acute trigger. Het is een klinisch syndroom dat wordt beschouwd als de laatste route van een veelheid aan ziekten die de hartfunctie beïnvloeden. Het is niet voldoende om de diagnose LoHF te stellen, de onderliggende oorzaak of trigger moet ook worden bepaald, en indien mogelijk, behandeld . Tabel 1 geeft een samenvatting van aandoeningen die een lage output toestand veroorzaken bij HF-patiënten.
Tabel 1. Etiologie van low-output staat door de pathofysiologie
|
Mechanismen |
Oorzakelijke Voorwaarden |
|
het Verlies van myocardiale contractiliteit |
Coronaire hartziekte, cardiomyopathie, myocarditis, gedecompenseerde chronische HF, post-cardiale chirurgie, giftige stoffen, voeding (overgewicht)m infiltratieve ziekten, eindstadium nierfalen, de ziekte van Chagas of HIV-infectie |
|
een Verminderde ventriculaire vulling of uitwerpen |
Pericarditis, pericardiale effusie, cardiale tamponnade, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
de huidige kennis van de pathofysiologie van LoHF berust grotendeels op het bewijs uit klinische studies met postoperatieve CABG-patiënten . Het pathologische keurmerk is excessief ingedrukt CO, vergezeld van hypoperfusie aan het eind van het orgaan. Fysiologisch functioneert het hart als een pomp om zuurstofrijk bloed in voldoende hoeveelheden te verdelen om aan de metabolische behoeften van weefsels te voldoen. Aangezien de metabolische behoeften onder normale en stressvolle situaties variëren, varieert CO ook om aan deze dynamische vraag te voldoen . De diastolische fase van de hartcyclus is cruciaal bij LoHF-patiënten, omdat coronaire vulling tijdens ventriculaire ontspanning optreedt om myocardiale oxygenatie te bieden . De hartslag (HR) is ook significant in diastole omdat een te snelle HR verhindert dat het hart volledige myocardiale ontspanning en perfusie bereikt. Cardiale disfunctie is dus het gevolg van structurele (resterende cardiale anomalie) of functionele hartaandoening (stoornissen in ventrikel vulling of lediging, of verhoogde systemische vasculaire weerstand ).
Pathofysiologisch is CO afhankelijk van de HR en het slagvolume (SV) (CO = HR * SV). Slagvolume is op zijn beurt het netto product van drie onderling gerelateerde circulatievariabelen: preload, afterload en contractiliteit. Als een of meer van deze componenten is aangetast, kan zich een lage cardiale output toestand ontwikkelen . Bovendien beïnvloeden deze componenten zowel de systolische als de diastolische fasen van de cardiale cyclus, waardoor LV/RV systolische disfunctie en/of diastolische disfunctie ook bekend als HF met een behouden ejectiefractie (figuur 1). Andere voorwaarden zoals hartklepziekte, pulmonale hypertensie( PH), mechanische klepdisfunctie, en respiratoire mislukking kunnen de ontwikkeling van LoHF precipiteren of verergeren .
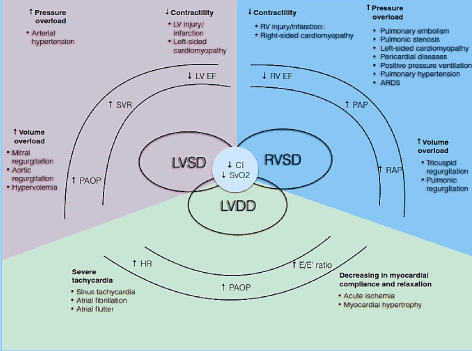
figuur 1. Pathofysiologische mechanismen van hartfalen met een lage output
vaak voorkomende oorzaken en typische; symptomen van LoHF zijn inbegrepen. De belangrijkste pathofysiologische mechanismen van LoHF is ventriculaire dysfunctie: Systolische en/of diastolische dysfunctie van de LV en systolische dysfunctie van de RV, die alle gemeenschappelijke pathologische kenmerken hebben van een verlaagde cardiale index (CI) en een verminderde gemengde veneuze zuurstofsaturatie (SvO2). LV en RV systolische disfunctie zijn het gevolg van verhoogde drukoverbelasting, verhoogde volumeoverbelasting en verminderde contractiliteit, terwijl LV diastolische disfunctie het gevolg is van ernstige tachycardie en verminderde myocardiale compliance en ontspanning. Aangepast van Lomivorotov et al. 2017, blz. Systolische dysfunctie (of depressieve LV-ejectiefractie) is het meest voorkomende pathofysiologische mechanisme dat wordt gezien bij LoHF-patiënten. Circulatievariabelen die de systolische functie van de LV beïnvloeden, zijn preload, after load en contractiliteit . Over het algemeen is systolische dysfunctie van de LV een gevolg van het verlies of de vermindering van functionele cardiomyocyten als gevolg van necrose als gevolg van een gestoorde coronaire circulatie en ischemie, reperfusie-letsel of het minder begrepen natuurlijke fenomeen van cardiomyocyt apoptose . Het verlies van functionele cardiomyocyten kan van voorbijgaande aard zijn, zoals wordt waargenomen tijdens een myocardiale bedwelming, gedefinieerd als een levensvatbaar myocardium geborgen door coronair reperfusie, dat een langdurige post-ischemische disfunctie vertoont na reperfusie . Het verlies van functionele cardiomyocyt kan ook ongevoelig zijn voor omkering in omstandigheden zoals infectie; tachycardie; valvulaire ziekte; metabole stoornissen zoals acidose, hypoglykemie, hypocalciëmie; blootstelling aan milieu cardiale toxines en chemicaliën; idiopathische gedilateerde cardiomyopathie (DCM); en genetische aandoeningen zoals familiale DCM, hypertrofische cardiomyopathie en spierdystrofie . Een verstoorde cardiale respons op preload veroorzaakt een dramatische afname van CO-en zuurstofafgifte naar andere belangrijke lichaamsorganen, verhoogde atriale druk, capillaire wigdruk en cardiogeen longoedeem. Hoewel compenserende veranderingen in de LV zich aanpassen aan een relatief hoge systemische arteriële druk, kan een significante toename van de afterload de LV systolische disfunctie induceren .
LV diastolische disfunctie
hoewel dit soms voorkomt, kan LoHF zich ontwikkelen bij patiënten met LV diastolische disfunctie met behoud van LVEF. De voorwaarde vloeit voort uit het onvermogen van de ventriculaire kamer te vullen met voldoende volume van bloed ondanks normale preload, die presenteert als diastolische dysfunctie . Onderliggende aandoeningen zoals ernstige tachycardie, verminderde myocardiale compliance of abnormale ventriculaire relaxatie tasten de ontspanning en vulling van de LV aan tijdens de diastolfase van de cardiale cyclus. Op cardiomyocytniveau worden deze aandoeningen geassocieerd met calciumverwijdering uit de cytosol-en calciumhomeostase, de adequaatheid van Cross-bridge-loslating en een intrinsieke functionele cytoskeletale elementaandoening . Cross-bridge loslating kan bijdragen aan vertraagde isovolumische relaxatietijd, wat resulteert in een verminderd LV slagvolume vooral bij hogere HR . LV ontspanning is ook afhankelijk van sarcoplasmatische reticulaire calciumion heropname en stikstofmonoxide signalering, die ook cross-bridge loskoppeling. Aangezien het proces van Cross-bridge loslating energieverslindend is, kan het een tekort in myocardiale energie veroorzaken en bijgevolg de LV myocardiale ontspanning vertragen .
ondanks dat diastolische disfunctie een wijdverbreid fenomeen is dat wordt waargenomen bij tot 70% van de postoperatieve hartpatiënten, is diastolische disfunctie alleen onvoldoende om de ontwikkeling van acute HF te verklaren. In het plaatsen van andere klinische voorwaarden zoals atrial fibrillation (AF), verminderde coronaire omloop, en arteriële hypertensie, kan diastolic dysfunctie in gedecompenseerde staat resulteren, en zo verondersteld om een vroeg teken van myocardiale ischemie te zijn . De dynamische relatie tussen de LV diastolische en systolische functies draagt ook bij aan diastolische disfunctie bij LoHF-patiënten. Stimulatie van inotrope catecholamine beïnvloedt zowel diastole als systole, en kan diastolische dysfunctie verbeteren. Een verlaagde LVEF leidt tot een toename van het end-systolisch volume en verlengt de diastolische fase van de cardiale cyclus .
RV disfunctie
bij LoHF, met name na coronaire arteriële chirurgie, omvatten de belangrijkste pathofysiologische mechanismen van RV disfunctie een verhoogde preload, een verhoogde afterload, een verstoorde perfusie van de rechter coronaire arterie en een verminderde contractiliteit . In tegenstelling tot de linker kransslagader treedt de perfusie van de rechter kransslagader op tijdens zowel diastole als systole. De aanwezigheid van PH veroorzaakt een verhoging van de RV druk die leidt tot verminderde rechter coronaire perfusie, wat het belang verklaart voor het verstrekken van een optimale linker en rechter coronaire circulatie. Bij patiënten die coronaire arteriële chirurgie hebben ondergaan, RV disfunctie kan ontwikkelen als gevolg van een combinatie van mechanismen. Perioperatieve RV ischemie en infarct zijn de belangrijkste oorzaken van verminderde RV contractiliteit. Tricuspide of pulmonische regurgitatie re veel voorkomende oorzaken van verhoogde volume preload terwijl linkszijdige valvulaire ziekte of cardiomyopathie, PH of longembolie (PE), acute respiratory distress syndrome en hoge positieve druk ventilatie zijn veel voorkomende oorzaken van druk overbelasting . Aangezien de RV normaal gesproken lagedrukperfusie van de pulmonale vasculatuur mogelijk maakt, is het zeer gevoelig, zelfs voor matige verhogingen van de pulmonale arteriële druk (PAP). RV falen kan zich ontwikkelen in de setting van PH of verminderde contractiliteit geassocieerd met een snelle progressie van RV dilatatie leidt tot verhoogde end-diastolische RV druk . Deze fysiologische veranderingen kunnen leiden tot een interventriculaire septum verschuiving naar een reeds ondergevulde LV kamer en bijgevolg een vermindering van LV preload en een afname van CO .
risicofactoren
risicofactoren voor LoHF blijven een onder-onderzocht gebied. Er zijn echter weinig gegevens beschikbaar uit klinische studies met HF en van postoperatieve LCOS patiënten die waardevolle inzichten verschaffen in risicofactoren en voorspellers van LoHF. In analyse van 452 patiënten die in het ziekenhuis werden opgenomen met gedecompenseerde HF en een laag cardiaal output, waren significante risicofactoren voor LoHF de ziekte van Chagas (relatief risico : 3,66), depressieve ejectiefractie (RR: 2,41), hyponatriëmie (RR: 1,62) en nierdisfunctie (RR: 1,92) . Risicofactoren voor postoperatieve LoHF zijn onder meer een verminderde LV-functie (< 50%), CABG-on-pump, nood-of cardiopulmonale bypass (CPB) – operatie, onvolledige revascularisatie, leeftijd > 65 jaar, en een gecombineerde aanwezigheid van diabetes mellitus en preoperatieve nierdisfunctie . Naast de patiënt-en operatierisicofactoren zijn biochemische voorspellers van LoHF bij postoperatieve patiënten lage hemoglobinewaarden, totaal aantal lymfocyten < 2000 cellen/µL en preoperatieve spiegels van natriuretische peptiden in serum . In de afgelopen twee decennia zijn er veranderingen opgetreden in de trends van sommige erkende risicofactoren. Factoren zoals hypertensie, vrouwelijk geslacht, drievoudige vaatziekte en linker hoofdziekte zijn niet langer statistisch significant, terwijl het risico geassocieerd met depressieve pre-operatieve ejectiefractie is verdubbeld .
diagnose
Er zijn geen consensusrichtlijnen of bewezen diagnostische criteria voor LoHF-patiënten. Bovendien zijn klinische tekenen en symptomen niet-specifiek. Bij gebrek aan gestandaardiseerde richtlijnen berust de diagnose gewoonlijk op een geaccepteerde verzameling van hemodynamische en fysiologische afwijkingen die nuttig zijn voor het verhogen van klinische verdenking van LoHF . Diagnose van LoHF alleen is vaak niet genoeg. De oorzaak van de lage output toestand moet ook worden vastgesteld. In sommige oorzaken van low-outputstaat zoals PE of MI, is het behandelen van de onderliggende oorzaak de belangrijkste overweging en dus is het noodzakelijk om de diagnose te stellen. Aangezien lohf patiënten vaak onstabiel zijn, is het ook gemeenschappelijk voor klinische evaluatie, diagnose en behandeling om gelijktijdig meer zo in scherpe zorginstellingen voor te komen .
tekenen en symptomen
laag hartminuutminput aangezien het gepresenteerde kenmerk van acute gedecompenseerde HF soms voorkomt en slechts 8,9 tot 9,6% van de gehospitaliseerde HF-patiënten treft . LoHF kan veel klinische kenmerken met CHF delen, maar er zijn opmerkelijke verschillen die latere diagnostische beslissingen kunnen ondersteunen of begeleiden. Overmatige vermoeidheid en verhoogde inspanningsintolerantie zijn belangrijke eerste tekenen die door LoHF-patiënten zelfs vóór de diagnose worden opgemerkt . Bovendien vertonen LoHF-patiënten zich vaak met agitatie, verwardheid en/of verminderd bewustzijn; koude/vasoconstricteerde periferie of vertraagde capillaire navultijd; hypotensie; tachycardie of bradycardie; zwakke pols; verhoogde halsadervochtdruk; kortademigheid en hypoxemie; en oligurie/anurie . Deze tekenen en symptomen kunnen verschillen tussen lage perfusie en congestie bij HF-patiënten (Tabel 2).
Tabel 2. Symptomen en tekenen van lage perfusie vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: De 2016 ESC richtlijnen voor diagnose en beheer van HF benadrukken het belang van het verkrijgen van gedetailleerde patiëntgeschiedenis en lichamelijk onderzoek op alle patiënten waarvan wordt vermoed dat ze HF hebben . Gedetailleerde anamnese van de patiënt, of familielid en vrienden als de patiënt te ziek is, moet zich richten op het verkrijgen van informatie over symptomen, eerdere en huidige cardiale en extra-cardiale aandoeningen die HF kunnen precipiteren of verergeren, blootstelling aan risicofactoren van HF of van lage-output toestand, en medicatiegeschiedenis voor eerdere en huidige medische aandoeningen . Naast de voorgeschiedenis van de patiënt wordt lichamelijk onderzoek aanbevolen voor alle LoHF-patiënten om klinische indicatoren voor hemodynamische, perifere perfusie, congestie, onderliggende etiologie en valvulaire pathologie te beoordelen. Hemodynamische parameters van belang zijn bloeddruk, HR en hartritme, galop ritme, zuurstofverzadiging, en ademhalingssnelheid . Tests voor perifere perfusie dienen onder meer bewustzijnsniveaus, perifere huid/centrale temperatuur, capillaire navultijd en urineproductie te omvatten. Tests voor congestie omvatten verhoogde halsaderdruk, perifeer/pulmonaal oedeem, hepatomegalie, ascites en pleurale effusies. Tests voor de onderliggende etiologie moeten cardiovasculair onderzoek, en hartgeluid en geruis omvatten. Tot slot dient het bewijs voor valvulaire disfunctie te bestaan uit pericardiale rub en bewijs van pericardiale effusie met of zonder harttamponade .
De combinatie van de voorgeschiedenis van de patiënt en lichamelijk onderzoek is van onschatbare waarde gebleken bij de beoordeling van de hemodynamische status en de herkenning van LoHF . In 1976, Forrester et al. uitgevoerd lichamelijk onderzoek bij patiënten met een acuut myocardinfarct en geïdentificeerd vier hemodynamische profielen (A, B, L en C) zoals weergegeven in Figuur 2. Hemodynamische profielen zijn gebaseerd op de aanwezigheid of afwezigheid van pulmonale congestie (pulmonale capillaire wigdruk > of ≤ 18 mmHg) en de adequaatheid van perfusie (CI > 2,2 L/min/m2). Profiel A vertegenwoordigt geen congestie / hypoperfusie; profiel B congestie zonder hypoperfusie; profiel C hypoperfusie zonder congestie; en profiel L congestie en hypoperfusie . LoHF-patiënten vallen onder profielen L en C (hypoperfusie ± congestie op basis van Nohria et al. bewijs dat profiel L en C een gemiddelde CI hebben van respectievelijk 1,6 L/min/m2 en 1,9 L/min/m2.
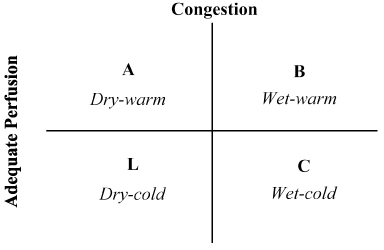
Figuur 2. Schematische weergave van het klinisch profiel van acuut gedecompenseerd hartfalen
congestie wordt beoordeeld aan de hand van de aanwezigheid van orthopneu, halsveneuze distensie, pulmonale rales, hepatojugulaire reflux, ascites, perifeer oedeem, abdominale reflux en vierkantsgolf van Valsalva. Lage perfusie werd beoordeeld aan de hand van de aanwezigheid van een smalle polsdruk, veranderingen in de pulsen, koude extremiteiten, misschien slaperig, dalende serumnatriumspiegels en verslechtering van de nierfunctie. Aangepast van Nohria, et al.
elektrocardiogram (ECG): zowel de AHA-als de ESC-richtlijnen over HF bevelen aan dat elektrocardiogram (ECG) zo vroeg mogelijk moet worden uitgevoerd bij alle patiënten waarvan wordt vermoed dat ze HF hebben. ECG kan een verscheidenheid aan afwijkingen aantonen en het is zeer onwaarschijnlijk dat het normaal is bij HF-patiënten. Het kan ook wijzen op een onderliggende etiologie van cardiale dysfunctie, waaronder bradycardie, atrioventriculair blok, sinustachycardie, atriale of ventriculaire tachyaritmie, ischemie, LV hypertrofie en laagspanningscomplexen .
Basislaboratoriumtests: de AHA en ESC HF-richtlijnen bevelen ook basislaboratoriumtests aan in de eerste klinische evaluatie ter ondersteuning van de diagnose van HF of van de oorzaak van de lage uitgangssituatie. Bloedonderzoek moet worden uitgevoerd bij alle vermoede HF-patiënten. Hemoglobine (HB > 10 g/dL) duidt op optimale zuurstoftoevoer naar weefsels), komt chronische anemie vaak voor bij chronische HF en sterk verhoogde witte bloedcellen doen vermoeden dat er een alternatieve diagnose wordt gesteld. Tests voor serumelektrolyt om de niveaus van kalium, magnesium en calcium te bepalen. Ureum – en creatininetests ter bepaling van renale hypoperfusie en disfunctie vaak bij HF. Testen voor een verminderde leverfunctie, wat wijst op een verminderde RV en/of levercongestie. Glucosetest ter beoordeling van hypoglykemie die de hartfunctie kan aantasten. Schildklierfunctietesten voor hypo-of hyper-thyroidisme dat intrinsiek myocardinfarct kan veroorzaken. Ten slotte, tests voor serum natriuretische peptiden waarvan de verhoogde niveaus wijzen op verhoogde spanning van de ventriculaire wand, maar die geen abrupte veranderingen in ventriculaire vullende druk detecteert vanwege hun lange halfwaardetijd .
cardiale beeldvormingstests: cardiale beeldvorming speelt een centrale rol bij de diagnose van HF en bij de monitoring en begeleiding van de therapie. Echocardiografie is de voorkeursmodaliteit om redenen van nauwkeurigheid, beschikbaarheid, veiligheid en kosteneffectiviteit . Het kan worden aangevuld met andere beeldvormingsmodaliteiten die worden geselecteerd op basis van het vermogen om specifieke klinische vragen te beantwoorden terwijl contra-indicaties en risico ‘ s worden overwogen .
echocardiografie: echocardiografie wordt sterk aanbevolen voor alle vermoede patiënten vanwege het vermogen om de klinische diagnose van LoHF te bevestigen of uit te sluiten, om SV en de variaties ervan te beoordelen en om de oorzaak van een lage-output toestand te bepalen . Transthoracale echocardiografie dient zo snel mogelijk na de klinische diagnose van een laag cardiaal output te worden uitgevoerd. Niet alleen meet het de omvang van systolische en diastolische dysfunctie, het biedt ook waardevolle informatie over ventriculaire morfologie, valvulaire dysfunctie, myocardiale en pericardiale ziekte en regionale wandbewegingsafwijkingen . Echocardiografie evalueert de systolische functie door het meten van LEVF, waarbij > 45-50% als normaal wordt beschouwd. Aan de andere kant wordt de diastolische functie geëvalueerd met behulp van mitralis in stromingspatronen, pulmonale Vene flow en weefseldoppler bij de mitralis annulus, terwijl CO en SV worden geëvalueerd met behulp van het Dopplerprincipe. Pulmonale arteriële druk (PAP) kan worden geschat door het meten van regurgitate jet snelheid. Hoge PAP in aanwezigheid van verwijde RV met septumafvlakking of buiging in de LV, wat wijst op een acute toename van de RV-druk, waardoor klinische verdenking van PE als de oorzaak van een lage outputtoestand toeneemt .
thorax X-ray: thorax x-ray kan worden overwogen bij patiënten waarvan wordt vermoed dat ze een LoHF hebben. Belangrijke indicatoren die voor beoordeling moeten worden overwogen, zijn een vergroot hart dat cardiomegalie of LV hypertrofie aangeeft; pulmonale veneuze congestie die wijst op verhoogde LV vuldruk; en pleurale effusie wijst op verhoogde LV druk, longembolie of post-cardiale chirurgie (.
coronaire angiografie: indicaties voor coronaire angiografie bij LoHF-patiënten moeten in overeenstemming zijn met de aanbeveling van relevante consensusrichtlijnen voor HF . Bij HF-patiënten met pijn op de borst en tekenen van een myocardinfarct met ST-elevatie (STEMI) op ECG, moet revascularisatie met behulp van primaire percutane coronaire interventie zo snel mogelijk worden uitgevoerd. Coronaire angiografie dient ook overwogen te worden bij patiënten met een ischemische etiologie na een hartstilstand, wanneer er aanwijzingen zijn voor HF en bij patiënten die hersteld zijn van een lage uitgangssituatie wanneer de oorzaak niet is vastgesteld .
klinische behandeling
de aanwezigheid van LoHF vertegenwoordigt een zeer hoog risico aandoening die onmiddellijke behandeling vereist, maar mist gestandaardiseerde richtlijnen voor klinische behandeling . Daarom overwegen artsen normaal gesproken individuele pathofysiologie om de meest geschikte behandelingsstrategie te kiezen . Bij acute LoHF-patiënten bevelen de 2016 ESC HF-richtlijnen het gebruik van hemodynamische profielen aan (gebaseerd op de aanwezigheid of afwezigheid van congestie en adequaatheid van perfusie) om de klinische behandeling te begeleiden . Voor LoHF-patiënten in profiel L (geen congestie maar hypoperfused) en profiel C (zowel congestie als hypoperfused) die zich in acute decompensatietoestand bevinden, kunnen noodbehandelingsdoelstellingen bestaan uit het reanimeren van patiënten, het herstellen van de oxygenatie, het verbeteren van de orgaanperfusie en het optimaliseren van de hemodynamica (slagvolume en CO) en het oplossen van symptomen. Andere daaropvolgende doelen zijn onder meer optimale monitoring en het vaststellen van de onderliggende oorzaak van een laag hartminuutvolume en het behandelen van de oorzaak indien omkeerbaar . Op dit moment zijn de beschikbare therapeutische doelen voor LoHF het optimaliseren van weefseloxygenatie, het stabiliseren van de circulatie en het behandelen van omkeerbare oorzaken van low-output toestand (Figuur 3).
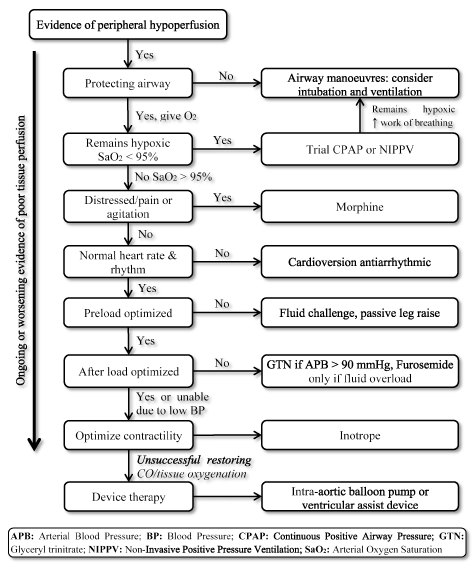
Figuur 3. Behandelingsalgoritme voor low-output hartfalen
behandeling van lohf-doelen die de weefseloxygenatie verbeteren en de circulatie stabiliseren op basis van aanhoudende of verergerende symptomen van weefselperfusie. Behandeling begint met het verbeteren van de ventilatie met behulp van de levering van hoge stroom zuurstof, continuous positive airway pressure (CPAP) of niet-invasieve positieve druk ventilatie (NIPPV). Als het niet lukt, worden cardioversie of antiaritmica gegeven om de hartslag te normaliseren, vochtuitdaging om de pre-load te optimaliseren, en/of vasodilatatoren en inotropen om respectievelijk de contractiliteit te manipuleren en te verbeteren. Als eerdere beademing en medicatie niet succesvol zijn in het herstellen van het hartminuutvolume en/of de weefseloxygenatie, kan therapie met een intra-aorta ballonpomp of ventriculaire assist worden overwogen
Optimaliseer de weefseloxygenatie (beademingsstrategieën)
klinische behandeling van LoHF-patiënten begint vaak met de beoordeling van de luchtwegen, ademhaling en circulatie voor bewijs van perifere hypoperfusie. Beademingsstrategieën zoals orofaryngeale of nasofaryngeale luchtwegen zijn gemeenschappelijke toevoegingen die worden gebruikt om de doorgankelijkheid van de luchtwegen te herstellen of te handhaven bij lohf-patiënten met een verlaagd bewustzijnsniveau als gevolg van een verminderde cerebrale perfusie. Aanvullende endotracheale intubatie dient overwogen te worden als de patiënt nog steeds een verminderde luchtwegen heeft . Als de patiënten hypoxisch blijven (SaO2 < 95%), kan een maximalisering van de zuurstofafgifte met behulp van zuurstof met hoge stroom, continue positieve luchtwegdruk (CPAP) of niet-invasieve positieve drukventilatie (NIPPV) worden overwogen. Bij patiënten zonder verbetering kan intubatie of beademing worden overwogen .
stabiliseer de circulatie
cardiale output (CO) is een functie van HR en SV. SV is op zijn beurt afhankelijk van vier circulatievariabelen: hartslag, voorspanning, contractiliteit en afterload. Het optimaliseren van al deze variabelen zal CO in lohf patiënten verbeteren . In klinische setting zijn strategieën om CO te verhogen afhankelijk van de onderliggende oorzaak en de aangetaste circulatievariabele . Klinische interventies omvatten volumeaanpassing, farmacologische ondersteuning en apparaattherapie.
hartslag / ritme: Als onderdeel van de fysiologische reactie van het lichaam, verhoogt het verhogen van HR CO. Te snelle of langzame HR heeft een nadelig effect op CO. Bij lohf-patiënten met tachycardie (te snel rustende HR > 100 bpm) die lijden aan stress, rusteloosheid en dyspnoe, kan morfine worden toegediend om dyspneu, pijn en agitatie te verlichten en is het een lichte venodilator voor het verminderen van de afterload, vooral bij CPAP-of NIPPV-patiënten . Indien HR < 40 bpm met tekenen van hemodynamisch compromis en/of verstoorde CO, moet medicatie die HR verhoogt (atropine en anticholinergica ) of interventies zoals transcutane/transveneuze pacing worden uitgevoerd. Dringende elektrische cardioversie dient overwogen te worden bij geselecteerde LoHF met ventriculaire/supraventriculaire tachycardie of snelle AF met tekenen van cardiovasculair compromis .
optimaliseer preload (volume adjustments): meting van preload is essentieel voor de optimalisatie ervan. Het wordt aanbevolen bij patiënten met klinische aanwijzingen voor een verstoorde perifere perfusie. Er moet een vloeistof challenge worden uitgevoerd om de responsiviteit van de lading te beoordelen. Snel 250 ml vloeistof (kristalloïde of colloïd) injecteren gedurende meer dan vijf minuten en objectief beoordelen van het effect op SV. Als het effect een toename of afname is > 10%, moet de patiënt doorgaan met het ontvangen van vloeistofbolussen om de voorspanning te optimaliseren totdat deze niet langer reageren op vocht . Voor patiënten met tekenen van congestie en longoedeem die geen vloeistofbolus nodig hebben, kan een passieve beenverhoging worden gedaan – het been van de patiënt naar 45 graden tillen om de behoefte aan vochtuitdaging uit te sluiten. Als de respons als gunstig een echte vloeistof uitdaging kan worden gegeven .
Manipuleer de afterload (farmacologische ondersteuning): Afterload is de resistentie waartegen het ventrikel bloed uitwerpt, soms geschat als SVR. De Afterload dient te worden verminderd bij LoHF-patiënten met een hoge afterload, lage CO, tekenen van slechte perifere perfusie en longoedeem. Farmacologische ondersteuning met vasodilatatoren dient te worden gegeven aan LoHF-patiënten met een systolische BP ≥110 mmHg. Bij patiënten met systolische BP < 90 mmHG en gemiddelde arteriële druk < 65 mmHg worden vasodilatatoren niet aanbevolen vanwege het risico op hypotensie, wat de orgaanperfusie kan bemoeilijken. Bij deze patiënten wordt inotropen aanbevolen als de eerste regel van de behandeling .
Verbeter de contractiliteit (farmacologische ondersteuning): Als de patiënt ondanks interventies voor hartslag, voorspanning en afterload blijft bestaan met tekenen van weefselhypoperfusie of verminderde zuurstofafgifte, dient een behandeling ter verbetering van de contractiliteit te worden overwogen. Ondertussen moet de optimalisering van de zuurstofafgifte worden voortgezet om te streven naar hemoglobine ≥10 g/dl en om te zorgen voor optimale zuurstofverzadiging (SaO2). Factoren die de contractiliteit van het myocard nadelig beïnvloeden zijn hyperkaliëmie, hypomagnesiëmie, hypocalciëmie, ernstige acidose, hypoxie en hypoglykemie, die moeten worden gecorrigeerd. Inotropen worden aanbevolen om de contractiliteit en vervolgens CO te verbeteren bij LoHF-patiënten met lage BP en/of lage CI in aanwezigheid van tekenen van slechte perifere perfusie of congestie . Echter, farmacologische ondersteuning met Dobutamine (een inotroop) moet met voorzichtigheid worden gebruikt bij patiënten die tachycardie of AF hebben omdat het av-knoopgeleiding verhoogt en snelle ventriculaire ritmes kan neerslaan . Aan de andere kant wordt levosimendan aanbevolen bij LoHF-patiënten met acute myocardiale ischemische of postcardiale chirurgie, omdat het de zuurstofbehoefte van het myocard niet verhoogt . Het effect op lange termijn van inotropen zou schadelijk kunnen zijn en zo zou hun gebruik moeten worden gestopt zodra stabiliteit is bereikt. Vasopressoren dienen niet de eerstelijnsmedicatie te zijn in situaties met een lage output, aangezien ze de SVR verhogen en vervolgens CO aantasten. Echter, een dubbele behandeling van vasopressoren en inotrope wordt aanbevolen bij patiënten met sepsis als de onderliggende oorzaak van low-output toestand .
Apparaattherapie: Apparaattherapie moet worden overwogen bij LoHF-patiënten wanneer optimale medische behandelingen niet succesvol zijn gebleken bij het herstellen van CO-en weefseloxygenatie. Gemeenschappelijke apparaattherapieën omvatten intra – aorta ballonpomp (IABP) en ventriculaire assist apparaat (VAD). Het gebruik van IABP komt vaak voor bij LoHF-patiënten met ischemische hartziekten, pre-of post-percutane interventie of post-hartchirurgie. IABP bestaat uit een ballon ingebracht in de aorta via de dijbeenslagader. De ballon blaast op tijdens de diastole en laat leeglopen tijdens de systole om de diastolische BP en bijgevolg de coronaire perfusie te verhogen, en vermindert de afterload waardoor CO. Aan de andere kant is het gebruik van VAD ongewoon. Het kan alleen worden gebruikt in gespecialiseerde centra. Het wordt vaak gebruikt als brug naar harttransplantatie bij patiënten met een gunstige levenskwaliteit of voor herstel bij patiënten met acute myocarditis .
behandeling van onderliggende oorzaken
sommige oorzaken van low-output status bij patiënten met LoHF kunnen met specifieke therapieën worden omgekeerd. Reversibele oorzaken dienen vroeg tijdens de eerste klinische evaluatie te worden geïdentificeerd. Deze oorzaken omvatten acuut myocardiaal infarct, harttamponade, spanning pneumothorax, longembolie, en acute klep falen . (Tabel 3).
Meta-analyse van diagnose en klinische behandeling
de basis van de klinische diagnose van LoHF is echocardiografisch bewijs van LV/RV systolische disfunctie en / of LV diastolische disfunctie vergezeld van bewijs van verminderde CO en SvO2 . Hemodynamische profielen op basis van congestie-en perfusiemetingen zijn gebruikt om acute HF-patiënten te classificeren in vier profielen: droog-warm (a), nat-warm (B), droog-koud (L) en nat-koud (C) en nuttig bij het identificeren van LoHF-patiënten . LoHF-patiënten zijn geclassificeerd In profielen (L) en (C) op basis van de aanwezigheid/afwezigheid van congestie en/of de ontoereikendheid van perifere perfusie . Deze twee hemodynamische profielen hebben de basis gevormd voor het selecteren van patiënten met LoHF in klinische studies en bieden een eenvoudige beoordeling aan het bed om patiënten te helpen classificeren op het moment van presentatie en om de selectie van initiële therapieën te begeleiden . Het doel van deze meta-analyse is om gepubliceerd bewijs van gemeenschappelijke diagnostische kenmerken en behandelingsresultaten voor patiënten met LoHF samen te voegen.
zoekstrategie
drie belangrijke online databases (PubMed, EMBASE en Cochrane) werden vanaf het begin tot December 2018 systematisch doorzocht op onderzoeken naar diagnose en klinische behandeling van LoHF. Om niet te vergeten studies die niet LoHF in de titel of abstract vermeld, de eerste 200 relevantie-ranked artikelen opgehaald met een full-text Google Scholar search werden opgenomen. Er werden geen publicatietijd-of taalbeperkingen toegepast. Aanvullende studies werden geïdentificeerd door een handmatig zoeken van de lijst met referenties uit de opgenomen studies en uit relevante review artikelen, die vervolgens werden onderworpen aan de inclusiecriteria. De zoekcriteria omvatten populatie van belang (patiënten met LoHF of LCOS), diagnostische tests van belang (echocardiografie en hemodynamische profielen), en interventie van belang (beademingsstrategieën, volume aanpassing, farmacologische ondersteuning en hulpmiddel therapie). De onderzoeken werden opgenomen als zij aan de volgende criteria voldeden: (a) patiënten met LoHF werden geïncludeerd.; (b) gediagnosticeerd met behulp van echocardiografie en hemodynamische profielen; (c) behandelde patiënten voor hemodynamische stabilisatie; en (d) gerapporteerde behandelingsresultaten. In gevallen van studies waarbij dubbele gegevens werden gerapporteerd, werd alleen het onderzoek opgenomen dat het grootste aantal patiënten opleverde. Conference abstracts, case reports en review artikelen werden uitgesloten.
Onderzoeksselectie
Figuur 4 illustreert het Zoek-en screeningsproces dat wordt gebruikt om in aanmerking komende onderzoeken op te nemen. Twee reviewers screenden onafhankelijk van elkaar alle titels en samenvattingen uit de systematische online zoekopdracht. Abstracts met populatie, interventie en resultaten van belang werden opgenomen voor full-text search. Daarna hebben de twee beoordelaars ook onafhankelijk full-text artikelen getoetst aan de inclusiecriteria. In gevallen van discrepantie werd het opgelost door middel van discussie en consensus.

Figuur 4. Stroomdiagram van het literatuuronderzoek – en inclusieproces
gegevensverzameling
twee beoordelaars extraheerden onafhankelijk gegevens uit de geïncludeerde studies en elke discrepantie werd opgelost door consensus. De belangrijkste geëxtraheerde gegevens waren echocardiografische en hemodynamische profielgegevens, en de gebruikte behandeling en het resultaat van de behandeling op hemodynamisch (cardiale index, PCWP) en mortaliteit. Naast deze hoofdgegevens extraheerden de twee beoordelaars ook gegevens over de kenmerken van het onderzoek, de kenmerken van de patiënten en de duur van de follow-up (Tabel 4).
statistische analyse
resultaten van belang gerapporteerd in meer dan één studie zijn cardiale index, PCWP en mortaliteit. Voor elk resultaat werden samenvattende statistieken (gemiddelde ± standaarddeviatie) voor en na interventie geëxtraheerd of het verschil tussen baseline en na behandeling. Deze samenvattende statistieken werden afzonderlijk geëxtraheerd voor behandelings-en controle – /placebogroepen. Diagnostische resultaten en behandelingseffecten werden gemeten aan de hand van verschillen in middelen voor en na interventie en het bijbehorende 95% betrouwbaarheidsinterval. Bospercelen werden gebruikt om de heterogeniteit (I2) tussen studies visueel te onderzoeken. Gepoolde diagnostische en behandelingseffecten en het bijbehorende 95% betrouwbaarheidsinterval werden geschat met behulp van een vast effect (I2 < 49%) of een willekeurig effectmodel (I2 > 50%). P-waarde > 0,05 werd statistisch significant geacht.
resultaten
Onderzoekskenmerken
twaalf (12) gerandomiseerde gecontroleerde onderzoeken (RCT ‘ s) voldeden aan de inclusiecriteria. In zeven (7) studies werden LoHF-patiënten opgenomen en in de overige vijf (5) werden HF-patiënten opgenomen die een hartoperatie met een laag hartminuutvolume hebben ondergaan. De meerderheid van de gepubliceerde klinische studies (10) onderzocht medicatie waarbij het effect van verschillende soorten inotropen op hemodynamica en preventie van overlijden werd vergeleken: alleen dobutamine , dobutamine en dopamine ; levosimendan en dobutamine , en levosimendan en placebo . Van de overige twee klinische studies werden vasodilator (nitroprusside) en placebo, en apparaattherapie (iabp) en inotroop (levosimendan) alleen of in combinatie met IAPB onderzocht . In totaal namen 3.738 patiënten deel aan de 12 klinische onderzoeken, met een gemiddelde leeftijd van 64 jaar (bereik = 55-74 jaar), met een meerderheid van mannen (78%).
synthese van resultaten
diagnosegegevens over LoHF waren inconsistent. In de twaalf klinische onderzoeken kwam geen gemeenschappelijke definitie van LoHF naar voren die nuttig zou zijn geweest om de diagnose te sturen. Hemodynamische criteria voor inclusie van patiënten in de studies opgenomen CI < 2,0 L/min/m2 , CI < 2.2 L/min/m2 of CI < 2,5 L/min/m2 en PCWP > 15 mmHg of ≥18 mmHg . De definitie varieerde ook tussen de studies – postoperatieve conditie met hypotensie (systolische BP < 90 mmHg voor > 30 minuten) of de noodzaak voor inotrope ondersteuning om systolische BP > 90 mmHg en end-organ hypoperfusie (koude randgebieden, urine output < 30 ml/uur) . Cardiogene shock is beschreven als een complex syndroom met een cascade van acute LV-disfunctie, verminderd CO, hypotensie en weefselhypoperfusie .
Figuur 5 en 6 tonen bosdiagrammen voor gestandaardiseerde gemiddelde cardiale index bij baseline en na respectievelijk inotrope of vasodilatator therapie. De cardiale index bij baseline nam toe van een gemiddelde van 1,93 (95% BI: 1,91-1,95) tot een gemiddelde na de behandeling van 2,82 (95% BI: 2,80-2,84). Figuur 7 toont een bos plot voor standaard gemiddelde verschil (SMD) van cardiale index na behandeling met levosimendan en dobutamine. Levosimendan bereikt een hogere cardiale index in vergelijking met dobutamine (SMD: 2,82; 95% BI: 2,54-3,10). Als profylactisch middel tegen LoHF bij postoperatieve patiënten bereikte de infusie met levosimendan na anesthesie een hogere cardiale index (2,57) in vergelijking met preoperatieve IABP (2,3) of met een combinatie van levosimendan (2,4). Figuur 8 toont een bos plot van mortaliteit tussen levosimendan en placebo. Levosimendan had een lager sterftecijfer dan placebo (Odds Ratio : 0,83; 95% BI: 0,59-1,18) maar het verschil was niet statistisch significant (p=0,30). Tenslotte laat figuur 9 verder zien dat Levosimendan een lager sterftecijfer heeft in vergelijking met dobutamine (OR: 0,65; 95% BI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
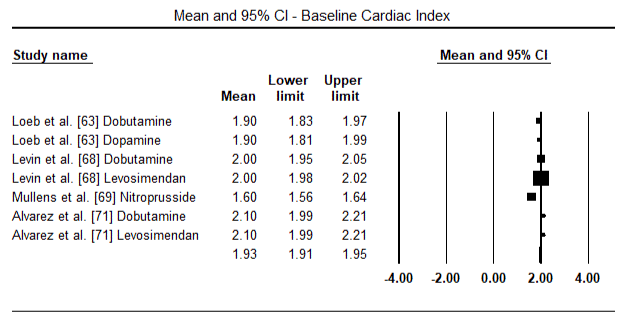
Figure 5. Mean baseline cardiac index
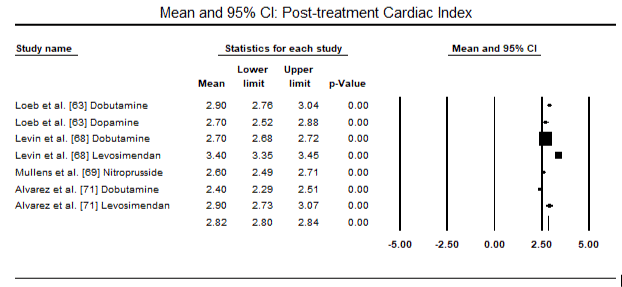
Figure 6. Mean post-treatment cardiac index
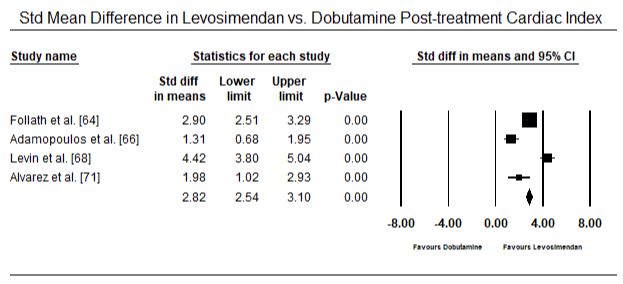
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
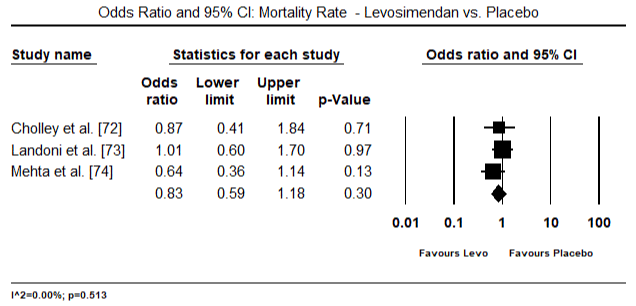
Figure 8. Mortality rate between levosimendan and placebo
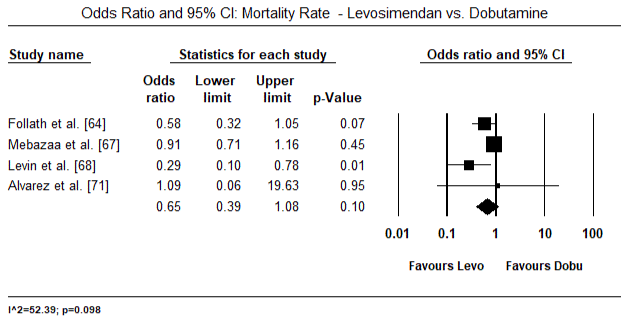
Figure 9. Mortaliteit tussen levosimendan en dobutamine
bespreking van bevindingen
deze systematische review en meta-analyse beoordeelde gemeenschappelijke diagnostische kenmerken en behandelingsresultaten van medical and device therapy (iabp) bij LoHF-patiënten. De resultaten geven aan dat LoHF-patiënten niet over algemeen aanvaarde of gestandaardiseerde diagnosefuncties beschikken. Hoewel LoHF-patiënten verschillende kenmerken kunnen vertonen, waaronder cardiale index, pcwp, systolische BP en SvO2 om klinische diagnose te suggereren of te ondersteunen, hebben al deze kenmerken verschillende cut-off-waarden in verschillende studies. Cardiale index, het meest voorkomende klinische kenmerk dat een lage uitgangstoestand in LoHF aantoont, heeft drie cut-off waarden: < 2,0 L/min/m2, < 2,2 L/min/m2 of < 2,5 L/min/m2 . Inotrope ondersteuning kwam naar voren als een veel voorkomende interventie voor het verbeteren van de perfusie en het normaliseren van de cardiale output bij LoHF-patiënten.
inotrope geneesmiddelen zoals levosimendan, dobutamine, dopamine, vasodilator (nitroprusside) en IABP verbeterden BI significant tussen baseline en post-behandeling. In termen van inotropen is levosimendan effectiever in het verbeteren van de hemodynamische stabiliteit en een beter profylactisch middel tegen kortetermijnsterfte (mortaliteit van 30 dagen) dan dobutamine. Bovendien kunnen inotropen als profylactisch optreden tegen de ontwikkeling van postoperatieve LoHF. Aan de andere kant, terwijl inotropen hemodynamisch verbeteren en hartoutput normaliseren, verstrekken zij geen beduidend betere bescherming tegen mortaliteit ongeacht het type van gebruikte inotrope.
de rol van inotropen bij de behandeling van LoHF werd ondersteund door een eerdere beoordeling van inotrope middelen en vasodilatatorstrategieën voor de behandeling van cardiogene shock en LCOS . Inotropen verbeteren hemodynamisch, bijwerkingen bij postoperatieve LCO ‘ s en verminderde mortaliteit. Nieuwere inotropen zoals levosimendan (een calciumsensibilisator en inodilator) is een positieve inotrope heeft enkele vaatverwijdende eigenschappen . Het kan ook worden beschouwd als een selectieve levervasodilator, die de portale veneuze stroom via de leverslagader en de portale veneuze stroom kan verbeteren in vergelijking met dobutamine die alleen de portale veneuze stroom kan verbeteren zonder de leverslagader te vasodilateren . Levosimendan verhoogt ook de zuurstofbehoefte van het myocard niet en wordt aanbevolen boven dobutamine bij LoHF-patiënten met acute myocardischemie of postcardiale chirurgie . Voor postoperatieve LoHF blijft het beschermende effect van inotropen tegen kortdurende mortaliteit (mortaliteit van 30 dagen) onbeduidend in vergelijking met placebo .
de huidige systematische evaluatie en meta-analyse heeft enkele belangrijke beperkingen. LoHF kan optreden in secundair aan onderliggende hartziekte zoals acuut myocardinfarct of postoperatief. De meeste studies omvatten onderzochte postoperatieve LoHF met minder presentatie van LoHF van andere oorzaken. De meeste studies richtten zich op twee inotropen (Levosimendan en dobutamine), die het begrip van andere inotropen evenals andere therapieën zoals apparaattherapieën beperken. In sommige onderzoeken liep de analyse het risico op misclassificatie bias als gevolg van een significant aantal patiënten verloren voor de follow-up. Aangezien in de meeste onderzoeken geen paarsgewijs verschil voor en na interventie met geassocieerde standaardafwijking wordt gerapporteerd, verschil voor en na interventie met standaardafwijking, worden de resultaten voor en na interventie als onafhankelijk gemeten, waardoor een grotere betrouwbaarheidsinterval wordt verkregen voor het effect van de behandeling met een geassocieerde standaardafwijking.
conclusie
hartfalen met een laag uitgangsvermogen (Lohf) is een klinisch syndroom dat gekenmerkt wordt door een verminderde cardiale output vergezeld van hypoperfusie aan het eind van het orgaan. Het is een zeldzame vorm van hartfalen in de algemene populatie, maar komt voor bij postoperatieve HF-patiënten. Zijn etiologie is heterogeen, die uit diverse voorwaarden bestaat die lage output toestand en hartchirurgie veroorzaken. De belangrijkste pathofysiologische mechanismen zijn systolische en/of diastolische dysfunctie van de LV en dysfunctie van de RV veroorzaakt door veranderingen in de hartslag, preload, afterload en/of contractiliteit. Algemene risicofactoren voor LoHF zijn de ziekte van Chagas, depressieve ejectiefractie en nierdisfunctie, terwijl bij postoperatieve patiënten een verminderde LV-functie, onvolledige revascularisatie, oudere leeftijd en aanwezigheid van diabetes en nierdisfunctie zijn. De diagnose ontbeert gestandaardiseerde richtlijnen en is afhankelijk van geaccepteerde verzameling van hemodynamische en fysiologische aberraties met inbegrip van voorwaarden die lage output toestand veroorzaken. De geschiedenis van de patiënt en lichamelijk onderzoek helpen om hemodynamische status te beoordelen en lage output staat te erkennen terwijl echocardiografie ventriculaire dysfunctie (HF) en lage cardiale output bevestigt. Andere tests ter ondersteuning van de diagnose of vaststelling van de oorzaak van low-output toestand omvatten elektrocardiogram en fundamentele laboratoriumtests (bloed, serum elektrolyt, ureum en creatinine, levertest, schildklierfunctie en serum natriuretische peptiden) en cardiale beeldvorming (thorax x-ray Of coronaire angiografie). De behandeling mist vastgestelde richtlijnen, maar hangt af van de beoordeling van de individuele pathofysiologie om de meest geschikte behandelingsstrategie te selecteren. De behandeling omvat beademingsstrategieën om de hartslag en het ritme te verbeteren; volumeaanpassing om de preload te optimaliseren; farmacologische ondersteuning (inotropen en vasodilatoren) om de afterload te manipuleren en de contractiliteit te verbeteren; en apparaattherapie (intra-aorta ballonpomp of ventriculaire assist apparaat) wanneer deze strategieën de cardiale output niet herstellen. Bij geselecteerde patiënten kunnen therapieën om de onderliggende ziekte om te keren, de cardiale output herstellen.
- Inamdar a, Inamdar A (2016) diagnose, behandeling en gebruik van hartfalen. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) Recent developments in heart failure. Circ Res 117: e58-63. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Ontwikkeld in samenwerking met de Heart Failure Association (HFA) van het ESC. EUR J Heart Fail 14: 803-869.Yancy CW, Jessup M, Bozkurt B, Butler J ,Casey De, et al. (2013) 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 62: e147-239.Ponikowski P, voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 ESC richtlijnen voor de diagnose en behandeling van acuut en chronisch hartfalen: De Task Force voor de diagnose en behandeling van acuut en chronisch hartfalen van de European Society of Cardiology (ESC) is ontwikkeld met de speciale bijdrage van de Heart Failure Association (HFA) van het ESC. EUR Hart J 37: 2129-2200.
- Masse l, Antonacci M (2005) Low cardiac output syndrome: identification and management. Crit Zorg Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) congestief hartfalen. Am J Respir Crit Care Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. EUR Hart J 26: 384-416.Parr GV, Blackstone EH, Kirklin JW (1975) Cardiac performance and mortality early after intracardiac surgery in infants and young children. Oplage 51: 867-874.Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) postoperatief verloop en hemodynamisch profiel na de arteriële schakeloperatie bij pasgeborenen en zuigelingen: een vergelijking van low-flow cardiopulmonale bypass en bloedsomloopstilstand. Oplage 92: 2226-2235.
- Hogue CW Jr, Sundt t 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) Cardial and neurologic complications identify risks for mortality for both men and women undergoing coronary artery bypass graft surgery. Anesthesiologie 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) Predictors of low cardiac output syndrome after coronary artery bypass. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) Epidemiologie en nieuwe voorspellers van low cardiac output syndrome na geïsoleerde coronaire bypass enten. EUR Hart J 31: 68-69. Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, et al. (2012) risicofactoren voor lage cardiale output syndroom na coronaire bypass enten operatie. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Predictors of low cardiac output syndrome after isolated coronary artery bypass surgery: trends over 20 years. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Management of the low cardiac output syndrome following surgery for congenitalary heart disease. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) Low-cardial-output syndrome after cardial surgery. J Cardiothorac Vasc Anesthes31: 291-308.
- Tibby SM., Murdoch IA (2003) Monitoring cardiac function in intensive care. Arch Dis Child 88: 46-52. Carcillo JA, Field AI (2002) Clinical practice parameters for hemodynamic support of paediatric and neonatal patients in septic shock. Crit Care Med 30: 1365-1378. Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) Cardiomyocyt death: mechanisms and translational implications. Celdood & ziekte 2: e244.
- Tavernarakis N (2007) Cardiomyocyte necrose: alternatieve mechanismen, effectieve interventies. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research 1773: 480-482.
- Dorn GW (2008) apoptotische en niet-apoptotische geprogrammeerde cardiomyocytsterfte in ventriculaire remodellering. Cardiovasc Res 81: 465-473.Richard Conti C (1991) The stunned and hibernating myocardium: a brief review. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) Diastolic heart failure after cardiac surgery. In coronaire hartziekte-huidige concepten in Epidemiologie, Pathofysiologie, diagnostiek en behandeling 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) welke mechanismen liggen ten grondslag aan diastolic dysfunction in heart failure? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment. EUR Hart J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) Is Phospholamban of troponine I de “prima Donna” in β-adrenerge geïnduceerde Lusitropie? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) Acute effects of stikstofmonoxide on left ventricular relaxation and diastolic distensibility in humans. Beoordeling door middel van bicoronair natriumnitroprusside-infusie. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) prevalentie van Left Ventricular Diastolic Filling Abnorrnalities in volwassen cardiale chirurgische patiënten: An Intraoperative Echo cardiographic Study. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) biventriculaire diastolische vulpatronen na coronaire bypassoperatie. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Pulmonary arterial hypertension: the key role of echocardiography. Borst 127: 1836-1843.
- Zochios V, Jones N (2014) Acute right heart syndrome in the critical zieke patiënt. Hart longvat 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Initial clinical experience with a miniaturized transesophageal echocardiography probe in a cardial intensive care unit. J Cardiothorac Vasc Anesth 29: 582-587.Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Performance of the right ventrikel under stress: Relation to right coronary flow. J Clin Invest 50: 2176-2183.
- Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Pulmonary vascular and right ventricular dysfunctie in adult critical care: Current and emerging options for management: A systematic literature review. Crit Zorg 14: R169.
- Pfisterer M (2003) betrokkenheid van de rechterkamer bij myocardinfarct en cardiogene shock. Lancet 362: 392-394.Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) voorspellers van lage cardiale output bij gedecompenseerd ernstig hartfalen. Klinieken 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Clinical outcome of urgent coronary artery bypass enting. J Korean Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David te (2005) Predictors of low cardiac output syndrome after isolated aortic valve surgery. Oplage 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) evaluatie van nutritional screening tools voor patiënten gepland voor hartchirurgie. Voeding 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) hemoglobine en B-type natriuretic peptide preoperative values but not inflammatory markers, are associated with postoperative morbidity in cardial surgery: A prospective cohort analytic study. J Cardiothorac Surg 8: 170. Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman in, Lomivorotov VN, et al. (2011) preoperatieve totale lymfocytentelling in perifeer bloed als een voorspeller van slechte uitkomst in volwassen hartchirurgie. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) n-terminale Pro-B-type natriuretisch peptide niveaus en vroege uitkomst na hartchirurgie: een prospectieve cohort studie. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Nut van B-type natriuretic peptide in het voorspellen van postoperatieve complicaties en uitkomsten in patiënten die hartchirurgie ondergaan. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) relatie tussen opname serum natriumconcentratie en klinische resultaten bij patiënten opgenomen voor hartfalen: een analyse van de OPTIMIZE-HF register. EUR Hart J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) in-hospital mortality in patients with acute decompensated heart failure requiring intraveneuze vasoactive medicines: an analysis from the Acute Decompensated Heart Failure National Registry (Adry). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Team management of patients with heart failure: a statement for healthcare professionals from the Cardiovascular Nursing Council of the American Heart Association. Oplage 102: 2443-24456.Stevenson LW, Perloff JK (1989) The limited reliability of physical signs for estimating hemodynamics in chronic heart failure. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) klinische beoordeling identificeert hemodynamische profielen die de resultaten voorspellen bij patiënten die zijn opgenomen met hartfalen. J Am Coll Cardiol 41: 1797-1804.Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Medical therapy of acute myocardinfarct by application of hemodynamic subsets. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) Medical management of advanced heart failure. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) Echocardiography in heart failure: applications, utility, and new horizons. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) echocardiografische evaluatie van hemodynamica bij patiënten met gedecompenseerd systolisch hartfalen. Circ Cardiovasc Imaging 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) Passency criteria for cardiovascular imaging use in heart failure: report of literature review. EUR Heart J Cardiovasc Imaging 16: 147-153.gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) Non-invasive cardial imaging evaluation of patients with chronic systolic heart failure: a report from the European Association of Cardiovascular Imaging (EACVI). EUR Hart J 35: 3417-3425.
- Vazir a, Cowie MR (2012) Assessing acute decompensated heart failure: Strategies and tools. Cardiol 8: 128-133 EUR.
- Gray A, Goodacre S, Newby de, Masson M, Sampson F, et al. (2008) niet-invasieve ventilatie in acuut cardiogeen longoedeem. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) Hemodynamic monitoring in acute heart failure. Crit Care Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) The intra-aortic balloon pump in heart failure management: implications for nursing practice. Aust Crit Care 22: 125-131.
- Slaughter MS, Singh R (2012) The role of ventricular assist devices in advanced heart failure. Revista Española de Cardiologia 65: 982-985. Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) Hemodynamic profiles of advanced heart failure: association with clinical characteristics and long-term outcomes. J Card Fail 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) Superiority of dobutamine over dopamine for augmentation of cardiac output in patients with chronic low output cardiac failure. Oplage 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, et al. (2002) werkzaamheid en veiligheid van intraveneus levosimendan vergeleken met dobutamine bij ernstig hartfalen met een lage output (het LIDO-onderzoek): een gerandomiseerde dubbelblinde studie. The Lancet 360: 196-202.Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) low-output, low-gradient aortastenose bij patiënten met depressieve linkerventrikel systolische functie: het klinische nut van de dobutamine challenge in het katheterisatielaboratorium. Oplage 106: 809-813.Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) effecten van levosimendan versus dobutamine op inflammatoire en apoptotische routes bij acuut gedecompenseerd chronisch hartfalen. Am J Cardiol 98: 102-106.Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007) Survive Investigators. Levosimendan vs dobutamine voor patiënten met acuut gedecompenseerd hartfalen: de Survive Randomized Trial. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) de calciumsensibilisator levosimendan geeft superieure resultaten aan dobutamine in postoperatief laag hartoutputsyndroom. Revista Española de Cardiología 61: 471-479. Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) Sodium nitroprusside for advanced low-output heart failure. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan versus een intra-aorta ballonpomp bij hartpatiënten met een hoog risico. J Cardiothorac Vasc Anth 26: 596-603. Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) een vergelijking van doubutamine en levosimendan n hepatische bloedstroom bij patiënten met een lage cardiale output toestand na cardiale chirurgie: een gerandomiseerde gecontroleerde studie. Anaesth Intensive Care 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Effect van levosimendan op een laag cardiaal outputsyndroom bij patiënten met een lage ejectiefractie die coronaire bypass-enten ondergaan met cardiopulmonale bypass: de LICORN gerandomiseerde klinische studie. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan voor hemodynamische ondersteuning na hartchirurgie. N Engl J Med 376: 2021-2031. Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendan bij patiënten met linkerventrikeldisfunctie die hartchirurgie ondergaan. N Engl J Med 376: 2032-2042. Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) inotrope middelen en vasodilatatorstrategieën voor de behandeling van cardiogene shock of low cardial output syndrome. De Cochrane Bibliotheek. 2 : 1-10.