Mupirocin Cream
Generieke naam: Mupirocin calcium
doseringsvorm: cream
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 1 Jan 2021.
- overzicht
- bijwerkingen
- dosering
- professionele
- zwangerschap
- meer
indicaties en gebruik voor Mupirocin Cream
Mupirocin Cream USP, 2% is geïndiceerd voor de behandeling van secundair geïnfecteerde traumatische huidletsels (tot 10 cm lang of 100 cm2 in oppervlakte) als gevolg van gevoelige isolaten van Staphylococcus aureus (S. aureus) en Streptococcus pyogenes (S. pyogenes).
Mupirocin crème dosering en toediening
- alleen voor topisch gebruik.
- breng een kleine hoeveelheid Mupirocin Cream, met een wattenstaafje of gaasje, 3 keer per dag aan op het aangedane gebied gedurende 10 dagen.
- bedek het behandelde gebied indien gewenst met gaasverband.
- herevalueer patiënten die geen klinische respons vertonen binnen 3 tot 5 dagen.
- Mupirocin crème is niet voor intranasaal, oogheelkundig of ander mucosaal gebruik .
- Mupirocin Cream NIET gelijktijdig met andere lotions, crèmes of zalven aanbrengen .
doseringsvormen en sterktes
Mupirocin Cream USP, 2% is een witte crème die 20 mg (2% G/G) mupirocin per gram bevat in een emulsie op olie – en waterbasis, geleverd in buisjes van 15 gram en 30 gram.
contra-indicaties
Mupirocin crème is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor mupirocin of voor één van de hulpstoffen van Mupirocin crème.
waarschuwingen en voorzorgen
ernstige allergische reacties
systemische allergische reacties, waaronder anafylaxie, urticaria, angio-oedeem en gegeneraliseerde rash, zijn gemeld bij patiënten die werden behandeld met formuleringen van mupirocine, waaronder Mupirocinecrème .
oogirritatie
Vermijd contact met de ogen. In geval van accidenteel contact goed afspoelen met water.
lokale irritatie
in geval van sensibilisatie of ernstige lokale irritatie door Mupirocin crème, moet het gebruik worden gestaakt en moet een geschikte alternatieve behandeling voor de infectie worden ingesteld.
Clostridium difficile-geassocieerde diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm leidt tot overgroei van C. difficile.
C. difficile produceert toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine-producerende stammen van C. difficile oorzaak verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig voor antimicrobiële therapie kan zijn en colectomie kan vereisen. CDAD moet worden overwogen bij alle patiënten met diarree na antibacterieel medicijngebruik. Zorgvuldige medische anamnese is noodzakelijk omdat CDAD is gemeld gedurende 2 maanden na toediening van antibacteriële middelen.
als CDAD wordt vermoed of bevestigd, kan het nodig zijn het gebruik van antibacterieel geneesmiddel dat niet gericht is tegen C. difficile te stoppen. Indien klinisch geïndiceerd, dienen geschikte vocht-en elektrolytenbehandeling, eiwitsuppletie, antibacteriële behandeling van C. difficile en chirurgische evaluatie te worden ingesteld.
potentieel voor Microbiële overgroei
net als bij andere antibacteriële producten kan langdurig gebruik van Mupirocin crème resulteren in overgroei van niet-waarneembare micro-organismen, waaronder schimmels .
risico geassocieerd met mucosaal gebruik
Mupirocin crème is niet geformuleerd voor gebruik op mucosale oppervlakken. Een afzonderlijke formulering, Mupirocin calcium nasale zalf, is beschikbaar voor intranasaal gebruik.
Negatieve Reacties
De volgende bijwerkingen zijn in meer detail besproken in andere delen van de etikettering:
- Ernstige Allergische Reacties
- Oogirritatie
- Lokale Irritatie
- Clostridium difficile-Geassocieerde Diarree
Klinische Proeven Ervaring
Omdat de klinische studies zijn uitgevoerd onder uiteenlopende omstandigheden, negatieve reactie tarieven waargenomen in de klinische studies van een drug kan niet rechtstreeks worden vergeleken met de tarieven in de klinische proeven van een andere drug en kan niet overeen met de tarieven in de praktijk waargenomen.
in 2 gerandomiseerde, dubbelblinde, dubbel-dummy onderzoeken werden 339 proefpersonen behandeld met topische Mupirocin crème plus orale placebo. Bijwerkingen traden op bij 28 (8,3%) proefpersonen. De volgende bijwerkingen werden gemeld door ten minste 1% van de proefpersonen in verband met het gebruik van Mupirocin crème in klinische onderzoeken: hoofdpijn (1,7%), huiduitslag (1,1%) en misselijkheid (1,1%).
andere bijwerkingen die voorkwamen bij minder dan 1% van de patiënten waren: buikpijn, branderig gevoel op de toedieningsplaats, cellulitis, dermatitis, duizeligheid, pruritus, secundaire wondinfectie en ulceratieve stomatitis.
in een ondersteunende studie bij de behandeling van secundair geïnfecteerd eczeem werden 82 proefpersonen behandeld met Mupirocin crème. De incidentie van bijwerkingen was als volgt: misselijkheid (4,9%), hoofdpijn en een branderig gevoel op de toedieningsplaats (elk 3,6%), pruritus (2,4%) en 1 melding van buikpijn, bloedingen secundair aan eczeem, pijn secundair aan eczeem, netelroos, droge huid en huiduitslag.
Postmarketing ervaring
naast de bijwerkingen die zijn gemeld in klinische studies, zijn de volgende bijwerkingen geïdentificeerd tijdens postmarketinggebruik van Mupirocin crème. Omdat ze vrijwillig worden gemeld bij een populatie van onbekende omvang, kunnen geen schattingen van de frequentie worden gemaakt. Deze reacties zijn gekozen voor inclusie vanwege een combinatie van hun ernst, frequentie van rapportage of mogelijk causaal verband met Mupirocin crème.
Immuunsysteemaandoeningen
systemische allergische reacties, waaronder anafylaxie, urticaria, angio-oedeem en gegeneraliseerde rash .
gebruik in specifieke populaties
zwangerschap
Risicosamenvatting
Er zijn onvoldoende gegevens bij de mens om vast te stellen of er een geneesmiddelgerelateerd risico is met Mupirocin crème bij zwangere vrouwen. De systemische absorptie van mupirocin door intacte menselijke huid Is minimaal na actueel beleid van Mupirocinroom . Er werd geen ontwikkelingstoxiciteit waargenomen bij ratten of konijnen die tijdens organogenese subcutaan werden behandeld met Mupirocin in doses van respectievelijk 160 of 40 mg per kg per dag (22 en 11 keer de lokale dosis bij de mens, gebaseerd op berekeningen van de dosis gedeeld door het gehele lichaamsoppervlak).
het geschatte achtergrondrisico op ernstige geboorteafwijkingen en miskramen voor de aangegeven populatie is onbekend. Het geschatte achtergrondrisico in de algemene bevolking van de V. S. van belangrijke geboortetekorten is 2% tot 4% en van miskraam is 15% tot 20% van klinisch erkende zwangerschappen.
gegevens
Diergegevens: Ontwikkelingstoxiciteitsstudies zijn uitgevoerd met Mupirocin subcutaan toegediend aan ratten en konijnen in doses tot 160 mg per kg per dag tijdens de organogenese. Deze dosis is 22 en 43 keer, respectievelijk, de menselijke actuele dosis (ongeveer 60 mg mupirocin per dag) gebaseerd op berekeningen van DOSIS gedeeld door het gehele lichaamsoppervlak. Maternale toxiciteit werd waargenomen (lichaamsgewicht verlies/verminderde gewichtstoename en verminderde voeding) bij beide diersoorten zonder aanwijzingen voor ontwikkelingstoxiciteit bij ratten. Bij konijnen sloot overmatige maternale toxiciteit bij de hoge dosis de evaluatie van foetale resultaten uit. Er was geen ontwikkelingstoxiciteit bij konijnen bij 40 mg per kg per dag, 11 maal de topische dosis bij de mens, gebaseerd op berekeningen van de dosis gedeeld door het gehele lichaamsoppervlak.
Mupirocin subcutaan toegediend aan ratten in een pre – en postnatale ontwikkelingsstudie (gedoseerd tijdens de late dracht tot en met lactatie) werd geassocieerd met een verminderde levensvatbaarheid van de nakomelingen in de vroege postnatale periode bij een dosis van 106.7 mg per kg, in aanwezigheid van irritatie op de injectieplaats en/of subcutane bloeding. Deze dosis is 14 maal de topische dosis bij de mens, gebaseerd op berekeningen van de dosis gedeeld door het gehele lichaamsoppervlak. De no-observed adverse effect level in deze studie was 44,2 mg per kg per dag, wat 6 maal de topische dosis bij de mens is.
borstvoeding
Risicosamenvatting
Het is niet bekend of mupirocin aanwezig is in de moedermelk, effecten heeft op het kind dat borstvoeding krijgt of effecten heeft op de melkproductie. Nochtans, wordt het geven van borstvoeding niet verwacht om in blootstelling van het kind aan het medicijn te resulteren toe te schrijven aan de minimale systemische absorptie van mupirocin in mensen na actueel beleid van Mupirocinroom . De ontwikkelings-en gezondheidsvoordelen van borstvoeding moeten worden overwogen samen met de klinische behoefte van de moeder aan Mupirocin-crème en eventuele mogelijke nadelige effecten op het kind dat borstvoeding krijgt van Mupirocin-crème of van de onderliggende maternale aandoening.
klinische overwegingen
om orale blootstelling van het geneesmiddel aan kinderen te minimaliseren, moet een borst en / of tepel die met Mupirocin crème wordt behandeld grondig worden gewassen voordat borstvoeding wordt gegeven.
pediatrisch gebruik
de veiligheid en werkzaamheid van Mupirocin crème zijn vastgesteld in de leeftijdsgroepen van 3 maanden tot 16 jaar. Het gebruik van Mupirocinroom in deze leeftijd-groepen wordt gesteund door bewijsmateriaal van adequate en goed gecontroleerde proeven van Mupirocinroom in volwassenen met extra gegevens van 93 pediatrische die onderwerpen als deel van de centrale proeven in volwassenen worden bestudeerd .
geriatrisch gebruik
In 2 adequate en goed gecontroleerde studies werden 30 proefpersonen ouder dan 65 jaar behandeld met Mupirocin crème. Er werd geen algemeen verschil waargenomen in de werkzaamheid of veiligheid van Mupirocin crème in deze patiëntenpopulatie vergeleken met die waargenomen bij jongere patiënten.
Mupirocin Cream beschrijving
Mupirocin Cream USP, 2% bevat het dihydraat kristallijn calciumhemi-zout van de antibacteriële RNA-synthetaseremmer, mupirocin. Chemisch is het (aE, 2S, 3R, 4R, 5S)-5-tetrahydro-3,4-dihydroxy-β-methyl-2H-pyran-2-crotonzuur, ester met 9-hydroxynonaanzuur, calciumzout (2:1), dihydraat.
de molecuulformule van mupirocine calcium is (C26H43O9 )2Ca 2 2H2O, en het molecuulgewicht is 1075,3. Het molecuulgewicht van Mupirocin vrij zuur is 500,6. De structuurformule van mupirocinecalcium is:
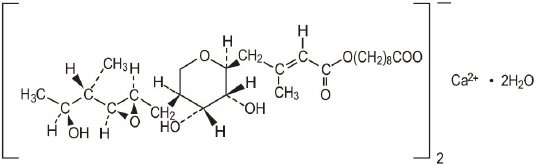
elke gram Mupirocinecrème bevat 20 mg (2% G/G) mupirocine equivalent aan 21,5 mg (2,15% g/g) mupirocinecalcium. The inactive ingredients are benzyl alcohol, cetomacrogol 1000, cetyl alcohol, mineral oil, phenoxyethanol, purified water, stearyl alcohol, and xanthan gum.
Mupirocin Cream – Clinical Pharmacology
Mechanism of Action
Mupirocin is an RNA synthetase inhibitor antibacterial .
Pharmacokinetics
Absorption
Systemic absorption of mupirocin through intact human skin is minimal. De systemische absorptie van mupirocin werd bestudeerd na toepassing van Mupirocin crème 3 maal daags gedurende 5 dagen op verschillende huidletsels groter dan 10 cm in lengte of 100 cm2 in oppervlakte bij 16 volwassenen (leeftijd 29 tot 60 jaar) en 10 kinderen (leeftijd 3 tot 12 jaar). Er werd enige systemische absorptie waargenomen, zoals blijkt uit de detectie van de metaboliet moninezuur in de urine. Gegevens uit dit onderzoek wezen op een frequenter optreden van percutane absorptie bij kinderen (90% van de proefpersonen) in vergelijking met volwassenen (44% van de proefpersonen); de waargenomen urineconcentraties bij kinderen (0,07 tot 1).3 mcg per mL ) liggen binnen het waargenomen bereik (0,08 tot 10,03 mcg per mL) bij de volwassen populatie. In het algemeen lijkt de mate van percutane absorptie na meervoudige dosering bij volwassenen en kinderen minimaal te zijn.
het effect van gelijktijdige toediening van Mupirocin crème met andere topische producten is niet onderzocht .
eliminatie
in een onderzoek uitgevoerd bij 7 gezonde volwassen mannelijke proefpersonen was de eliminatiehalfwaardetijd na intraveneuze toediening van mupirocine 20 tot 40 minuten voor mupirocine en 30 tot 80 minuten voor moninezuur.
metabolisme: Na intraveneuze of orale toediening wordt mupirocin snel gemetaboliseerd. De belangrijkste metaboliet, moninezuur, vertoont geen antibacteriële activiteit.
excretie: Moninezuur wordt voornamelijk via renale excretie geëlimineerd.
Microbiologie
Mupirocin is een antibacteriële RNA-synthetaseremmer die wordt geproduceerd door fermentatie met behulp van het organisme Pseudomonas fluorescens.
werkingsmechanisme
Mupirocin remt de bacteriële eiwitsynthese door reversibele en specifieke binding aan bacteriële ISOLEUCYL-transfer RNA (tRNA) synthetase.
Mupirocin is bactericide bij concentraties die worden bereikt door topische toediening. Mupirocin is sterk eiwitgebonden (meer dan 97%) en het effect van gekronkelde afscheidingen op de minimale remmende concentraties (MICs) van mupirocin is niet bepaald.
resistentie
wanneer mupirocinresistentie optreedt, is dit het gevolg van de productie van een gemodificeerde isoleucyl-tRNA synthetase, of de verwerving, door genetische overdracht, van een plasmide dat een nieuwe isoleucyl-tRNA synthetase medieert. Hoge plasmide-gemedieerde resistentie (MIC ≥512 mcg/mL) is gemeld bij toenemende aantallen isolaten van S. aureus en met hogere frequentie bij coagulase-negatieve stafylokokken. Mupirocinresistentie komt met grotere frequentie voor in methicilline-resistent dan methicilline-gevoelige stafylokokken.
kruisresistentie
vanwege het werkingsmechanisme vertoont mupirocin geen kruisresistentie met andere klassen antimicrobiële middelen.
antimicrobiële activiteit
mupirocine is werkzaam tegen gevoelige isolaten van S. aureus en S. pyogenes, zowel in vitro als in klinische studies . De volgende in vitro gegevens zijn beschikbaar, maar hun klinische significantie is onbekend. Mupirocin is actief tegen de meeste isolaten van Staphylococcus epidermidis.
Gevoeligheidstestmethoden
hoge mupirocineresistentie (≥512 mcg / mL) kunnen worden bepaald met behulp van standaardschijfdiffusie-of bouillonmicrodilutietests.1,2 wegens het voorkomen van mupirocinresistentie in methicilline-resistente S. aureus (MRSA), is het passend om MRSA-populaties te testen op gevoeligheid voor mupirocin voorafgaand aan het gebruik van mupirocin met behulp van een gestandaardiseerde methode.3,4,5
niet-klinische Toxicologie
carcinogenese, mutagenese, verminderde vruchtbaarheid
langetermijnstudies bij dieren om het carcinogeen potentieel van mupirocinecalcium te evalueren zijn niet uitgevoerd.
resultaten van de volgende onderzoeken uitgevoerd met mupirocinecalcium of mupirocinenatrium in vitro en in vivo wezen niet op een potentieel voor Genotoxiciteit: primaire hepatocyte ongeplande DNA-synthese bij ratten, sedimentanalyse voor DNA-strandbreuken, Salmonella reversion test (Ames), Escherichia coli mutatietest, metafase analyse van humane lymfocyten, muis lymfoom test, en beenmerg micronuclei test bij muizen.
in een fertiliteits – / reproductieve prestatiestudie (met dosering tijdens lactatie) resulteerde mupirocine subcutaan toegediend aan mannelijke en vrouwelijke ratten in doses tot 100 mg per kg per dag, wat 14 maal de humane topische dosis is (ongeveer 60 mg mupirocine per dag) gebaseerd op berekeningen van de dosis gedeeld door het gehele lichaamsoppervlak, niet in verminderde vruchtbaarheid of verminderde reproductieve prestaties toe te schrijven aan mupirocine.
klinische Studies
De werkzaamheid van topische Mupirocin crème voor de behandeling van secundair geïnfecteerde traumatische huidlaesies (bijv. in twee gerandomiseerde, dubbelblinde, dubbel-dummy klinische onderzoeken werden snijwonden, hechtwonden en schaafwonden van niet meer dan 10 cm lang of 100 cm2 in totaal) vergeleken met die van oraal cefalexine. De klinische werkzaamheidspercentages bij follow-up in de per-protocol populaties (inclusief volwassenen en pediatrische proefpersonen) waren 96,1% voor Mupirocin crème (n = 231) en 93,1% voor oraal cefalexine (n = 219). De eradicatiepercentages van pathogenen bij follow-up in de per-protocol populaties waren 100% voor zowel Mupirocin crème als oraal cefalexine.
Pediatrie
er waren 93 pediatrische patiënten van 2 weken tot 16 jaar per protocol opgenomen in de tweede geïnfecteerde huidlaesieonderzoeken, hoewel slechts 3 jonger dan 2 jaar waren in de populatie die werd behandeld met Mupirocin crème. Proefpersonen werden gerandomiseerd aan ofwel 10 dagen topische Mupirocin-crème 3 maal daags of 10 dagen oraal cefalexine (250 mg 4 maal daags voor proefpersonen groter dan 40 kg of 25 mg per kg per dag orale suspensie in 4 verdeelde doses voor proefpersonen kleiner dan of gelijk aan 40 kg). De klinische werkzaamheid bij follow-up (7 tot 12 dagen na de behandeling) in de per-protocol populaties was 97,7% (43 van 44) voor Mupirocin crème en 93,9% (46 van 49) voor cefalexine.
- Clinical and Laboratory Standards Institute (CLSI). Prestatienormen voor antimicrobiële gevoeligheidstesten; zesentwintigste informatieve aanvulling. CLSI-document M100-S26. Clinical and Laboratory Standards Institute, 950 West Valley Rd., Suite 2500, Wayne, PA 19087, Verenigde Staten, 2016.
- Patel J, Gorwitz RJ, et al. Mupirocin Resistentie. Klinische Infectieziekten. 2009; 49(6):935-41.
- Clinical and Laboratory Standards Institute (CLSI). Methoden voor verdunning antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; goedgekeurde standaard-tiende editie. CLSI-document M07-A10. Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, vs, 2015.
- Clinical and Laboratory Standards Institute (CLSI). Prestatienormen voor antimicrobiële Disk Diffusion Susceptibility Tests; Approved Standard-twaalfde editie. CLSI-document M02-A12. Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, vs, 2015.
- Finlay je, Miller LA, Poupard JA. Interpretatieve criteria voor het testen van de gevoeligheid van stafylokokken voor mupirocin. Antimicrob Agents Chemother 1997; 41 (5): 1137-1139.
hoe geleverd/opslag en hantering
Mupirocin crème is een witte crème die 20 mg (2% G/G) mupirocin per gram bevat in een emulsie op olie – waterbasis.
Mupirocin Cream USP, 2% wordt geleverd in 15-gram (NDC 16714-055-01) en 30-gram (NDC 16714-055-02) buizen.
Bewaren bij 20 ° tot 25 ° C . Niet in de vriezer bewaren.
informatie over Patiëntbegeleiding
adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering (patiëntinformatie) te lezen.
adviseer de patiënt om Mupirocin crème als volgt toe te dienen:
- gebruik Mupirocin crème alleen zoals voorgeschreven door de zorgverlener. Het is alleen voor extern gebruik. Vermijd contact van Mupirocin crème met de ogen. Als Mupirocin crème in de ogen komt, spoel dan grondig met water.
- gebruik Mupirocin crème niet in de neus.
- was uw handen voor en na het aanbrengen van Mupirocin Cream.
- gebruik een gaasje of wattenstaafje om een kleine hoeveelheid Mupirocin crème op het getroffen gebied aan te brengen. Het behandelde gebied kan worden bedekt met gaas dressing indien gewenst.
- meld tekenen van lokale bijwerkingen aan de zorgverlener. De room van Mupirocin zou moeten worden gestopt en de Gezondheidszorgverlener in contact worden gebracht als irritatie, het strenge jeuken, of uitslag voorkomt.
- meld het aan de zorgverlener of ga naar de dichtstbijzijnde eerste hulp als er ernstige allergische reacties optreden, zoals zwelling van de lippen, het gezicht of de tong of piepende ademhaling .
- indien na 3 tot 5 dagen geen verbetering wordt waargenomen, neem dan contact op met de zorgverlener.
vervaardigd voor: Northstar RxLLC
Memphis, TN 38141.vervaardigd door: Taro Pharmaceuticals Inc.Brampton, Ontario, Canada L6T 1C1.
uitgegeven: November 2020
5214500
54
| deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration. uitgegeven: November 2020 5214500 54 |
||
| patiëntinformatie Mupirocin (mue pir ‘ Oh sin) crème, for topical use |
Wat is Mupirocin crème? Mupirocin Cream is een voorschriftgeneesmiddel dat op de huid wordt gebruikt (topisch gebruik) voor de behandeling van bepaalde huidinfecties veroorzaakt door de bacteriën Staphylococcus aureus en Streptococcus pyogenes. Het is niet bekend of Mupirocin crème veilig en effectief is bij kinderen jonger dan 3 maanden. |
|
wie mag Mupirocin crème niet gebruiken?gebruik Mupirocin Cream niet als:
|
||
Wat moet ik mijn zorgverlener vertellen voordat ik Mupirocin crème gebruik?voordat u Mupirocin crème gebruikt, vertel uw zorgverlener over al uw medische aandoeningen, inclusief Als u:
vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en vrij verkrijgbare geneesmiddelen, vitaminen en kruidensupplementen. Meng Mupirocin room niet met andere lotions, crèmes of zalven. |
||
Hoe moet ik Mupirocin Cream gebruiken?
|
||
Wat zijn de mogelijke bijwerkingen van Mupirocin Cream?mupirocin crème kan ernstige bijwerkingen veroorzaken, waaronder:
|
||
|
|
|
de meest voorkomende bijwerkingen van Mupirocin Cream zijn:
dit zijn niet alle mogelijke bijwerkingen van Mupirocin Cream. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan FDA op 1-800-FDA-1088. |
||
Hoe moet ik Mupirocin crème bewaren?
|
||
| Algemene informatie over het veilige en effectieve gebruik van Mupirocin crème. geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan die vermeld in een bijsluiter. Gebruik Geen Mupirocin crème voor een aandoening waarvoor het niet werd voorgeschreven. Geef Mupirocin Cream niet aan andere mensen, zelfs niet als zij dezelfde symptomen hebben als u. Het kan schadelijk voor hen zijn. U kunt uw apotheker of zorgverlener om informatie vragen over Mupirocin Cream die is geschreven voor gezondheidswerkers. |
||
| wat zijn de bestanddelen van Mupirocin Cream? werkzaam bestanddeel: mupirocine calcium inactieve ingrediënten: benzylalcohol, cetomacrogol 1000, cetylalcohol, minerale olie, fenoxyethanol, gezuiverd water, stearylalcohol en xanthaangom vervaardigd voor: Northstar RxLLC, Memphis, TN 38141. Manufactured by: Taro Pharmaceuticals Inc., Brampton, Ontario, Canada L6T 1C1. For more information, call 1-800-206-7821. |
||
PRINCIPAL DISPLAY PANEL – 30 g Tube Carton
NDC 16714-055-02
Rx only
Mupirocin Cream USP
2%
FOR DERMATOLOGIC USE ONLY.
NORTHSTARx®
30 g

| MUPIROCIN mupirocin calcium cream |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-NORTHSTAR RX LLC (830546433)
Frequently asked questions
- kan ik mupirocin zalf gebruiken bij luieruitslag?
- kan Mupirocin genezen of helpen bij eczeem?
- kan mupirocin worden gebruikt voor voetsporters?
- kan mupirocincrème worden gebruikt bij zweren in bed?
meer over actuele mupirocin
- bijwerkingen
- Tijdens zwangerschap of borstvoeding
- doseringsinformatie
- vergelijk alternatieven
- Support Group
- prijzen & Coupons
- Spaans
- 38 beoordelingen
- geneesmiddelenklasse: topische antibiotica
li>
Consument hulpbronnen
- Patiënt Informatie
- Mupirocine Nasaal (Advanced Lezen)
- Actueel Mupirocine (Advanced Lezen)
Professionele hulpbronnen
- Prescribing Information
- Mupirocine (Professionele Patiënt Advies)
- Mupirocine (FDA)
Overige merken Bactroban Bactroban Nasale, Centany, Centany OP, Pirnuo
behandeling in Verband met gidsen
- Nasal Carriage of Staphylococcus aureus
- de Huid en de Structuur Infectie
- Secundair Cutane Bacteriële Infecties
- Impetigo
- Paronychia
medische Disclaimer