trawienie białek: etapy, enzymy i hormony
organizm wymaga białek, a zwłaszcza zawartych w nich niezbędnych aminokwasów. Zalecane dzienne spożycie dla zdrowego dorosłego osobnika wynosi 0,85 g/kg masy ciała, więc dla osoby o masie ciała 70 kg wynosi około 60 g, ale często w typowej zachodniej diecie spożycie jest większe niż 100 g / dzień.
oprócz białek pokarmowych organizm trawi również 50-100 g endogennych białek wydzielanych lub traconych do światła przewodu pokarmowego, a które wynikają z:
- śliny;
- sok żołądkowy;
- enzymy trzustkowe i inne wydzieliny;
- komórki jelitowe, które łuszczą się;
- białka, które przechodzą do światła jelita z krwiobiegu.
Ta mieszanina jest skutecznie trawiona i wchłaniana w dwunastnicy, pierwszej i najkrótszej części jelita cienkiego, z dzienną utratą przez kał równą około 1,6 g azotu, co odpowiada 10 g białka. Większość utraconego azotu jest wykorzystywana przez mikroflorę w okrężnicy do jej wzrostu, a zatem znajduje się w kale jako część masy bakteryjnej.
zawartość
- enzymy trawienne
- rola gotowania i żucia pokarmu
- etapy trawienia białka
- trawienie żołądka i białka
- trawienie białka i pepsyny
- trawienie dwunastnicy i białka
- Aktywacja zymogenów trzustkowych
- inhibitor trypsyny trzustki
- trawienie żołądka i białka
enzymy trawienne
trawienie białek następuje w wyniku hydrolizy wiązań peptydowych wiążących poszczególne aminokwasy w łańcuchu polipeptydowym. Reakcje te są katalizowane przez enzymy zwane proteazami.
proteazy jelitowe, specyficzne dla łańcucha bocznego aminokwasu, są hydrolazami, które można podzielić na dwie klasy:
- endopeptydazy, które hydrolizują wiązania peptydowe w łańcuchu polipeptydowym i są wytwarzane przez żołądek i zewnątrzwydzielniczą trzustkę;
- egzopeptydazy, które można podzielić na dwie grupy:
karboksypeptydazy, które usuwają aminokwasy z końca C i są produkowany przez zewnątrzwydzielniczą trzustkę;
aminopeptydazy, które działają na N-końcowym końcu i są wytwarzane przez enterocyty .

enzymy te są syntetyzowane i wydzielane w postaci nieaktywnej, zwanej zymogenami lub proenzymami.
w komórce zymogeny są przechowywane wewnątrz otoczonych błoną granulek zwanych granulkami zymogenu. Gdy komórka jest stymulowana przez określony sygnał, błona granulatu łączy się z błoną plazmatyczną, a zymogeny są uwalniane w wyniku egzocytozy.
proteazy te są syntetyzowane w nieaktywnej formie, aby uniknąć tego, że przed wydzieleniem trawią same siebie i/lub białka tkankowe. Dzieje się tak, że aktywne miejsce enzymu jest „zamaskowane” i dopiero po aktywacji białko może działać na substrat. Aktywacja jest wynikiem rozszczepiania, katalizowanego przez określony enzym, jednego lub więcej specyficznych wiązań peptydowych, z uwolnieniem jednego lub więcej segmentów łańcucha polipeptydowego. Pozwala to cząsteczce przyjąć trójwymiarową konformację, w której miejsce aktywne jest wolne i odpowiednio skonfigurowane.
nawet ich akumulacja w granulkach jest systemem ochronnym: izoluje je od innych cząsteczek obecnych w komórce.
większość białek w ich rodzimej konformacji jest odporna na działanie proteaz. Jest to konsekwencja ich drugorzędowej i trzeciorzędowej lub natywnej struktury, która maskuje wiele wiązań do działania enzymów. Struktury te są stabilizowane przez wiązania kowalencyjne, takie jak mosty dwusiarczkowe między resztami cysteiny i siły nie kowalencyjne, takie jak interakcje jonowe, wiązania wodorowe i siły van der Waalsa.
dla odpowiedniego trawienia białek niezbędne jest zatem, aby wiązania peptydowe były jak najbardziej dostępne dla działania proteaz jelitowych. Osiąga się to na zewnątrz organizmu poprzez gotowanie żywności, a wewnątrz organizmu przez kwaśne środowisko w żołądku.
rola gotowania i żucia żywności
gotowanie żywności, gdy nie jest nadmierne, ułatwia trawienie białka.
w jaki sposób?
jak wszystkie cząsteczki, również białka nie są nieruchome, ale wibrują. Wraz ze wzrostem temperatury białka wibrują z większą amplitudą, aż do zniszczenia wiązań niekowalencyjnych, które przyczyniają się do utrzymania rodzimej struktury. W związku z tym następuje zmiana konformacyjna białka, czyli cząsteczka jest denaturowana. Może to sprawić, że wewnętrzne wiązania peptydowe będą bardziej dostępne dla działania enzymów trawiennych.
nawet żucie i insaliwacja pokarmu homogenizują i nawilżają stałe składniki samego pokarmu, ułatwiając trawienie żołądka i jelita cienkiego.
etapy trawienia białka
w trawieniu białek biorą udział dwa etapy: pierwszy występuje w żołądku, a drugi w dwunastnicy, pierwszej części jelita cienkiego.
trawienie żołądka i białka
trawienie białka rozpoczyna się w żołądku i jest to „etap przygotowania” w porównaniu do zdarzeń, które występują w dwunastnicy.
obecność pokarmu w żołądku stymuluje komórki G błony śluzowej żołądka i proksymalnej dwunastnicy do produkcji i uwalniania hormonu gastryny do krwiobiegu. Hormon stymuluje komórki ciemieniowe właściwych gruczołów żołądkowych, zlokalizowane głównie na dnie narządu, do produkcji i wydzielania kwasu solnego do żołądka (komórki ciemieniowe produkują również czynnik wewnętrzny, białko, które wiąże witaminę B12, zapobiegając jej zniszczeniu i umożliwiając jej wchłanianie).
w prawidłowych gruczołach żołądkowych również stwierdzono:
- komórki śluzowe szyi, które wytwarzają śluz;
- komórki główne, które uwalniają pepsynogen.
wszystkie te substancje, wraz z innymi, takimi jak jony potasu i lipaza żołądkowa, są obecne w soku żołądkowym, którego pH wynosi od 1 do 2,5.
ze względu na niskie pH sok żołądkowy ma działanie antyseptyczne, zabijając większość bakterii i innych obcych komórek oraz efekt denaturacji, ponieważ łamie wiązania niekowalencyjne, które utrzymują natywną strukturę białek. Ten efekt denaturacji ułatwia dostęp proteazy jelitowej do wiązań peptydowych, takich jak ogrzewanie podczas gotowania. Niektóre białka bogate w wiązania dwusiarczkowe, takie jak keratyny, są odporne na denaturację przez niskie pH, a zatem trudne do strawienia. Wręcz przeciwnie, większość białek kulistych jest prawie całkowicie hydrolizowana do aminokwasów składowych.
wreszcie niskie pH soku żołądkowego aktywuje pepsynogen, zymogen, do pepsyny, pierwszego enzymu biorącego udział w trawieniu białek.
trawienie białka i pepsyna
istnieją różne izoenzymy pepsynogenu, takie jak typ i, syntetyzowane przez komórki ciała i dna żołądka, oraz typ II, który jest produkowany we wszystkich regionach narządu. Wszystkie izoenzymy są przekształcane w aktywny enzym. Aktywacja następuje w autokatalizie, przy wartościach pH poniżej 5, w procesie wewnątrzcząsteczkowym, polegającym na hydrolizie specyficznego wiązania peptydowego i uwalnianiu małego peptydu Z N-końcowego końca proenzymu. Peptyd ten pozostaje związany z enzymem i nadal działa jako inhibitor, dopóki pH nie spadnie poniżej 2 lub dopóki nie zostanie dalej rozkładany przez samą pepsynę. Tak więc, po utworzeniu pepsyny, to szybko aktywuje inne cząsteczki pepsynogenu.
pepsyna, endopeptydaza o optymalnym pH aktywności 1,6, hydrolizuje 10-20% białek w posiłku. Wiele enzymów trawiennych jest w stanie działać na szeroką gamę substratów, a pepsyna nie jest wyjątkiem, katalizując rozszczepienie wiązań peptydowych w sąsiedztwie reszt aminokwasowych, takich jak leucyna i fenyloalanina, tyrozyna i tryptofan (aminokwasy aromatyczne). Powstaje mieszanina peptydów o dużych rozmiarach i kilku wolnych aminokwasów.
działanie pepsyny jest ważne nie tyle ze względu na jej bezpośredni udział w trawieniu białek, to jest skromny, ale na uwalnianie peptydów i aminokwasów, które na poziomie dwunastnicy stymulują wydzielanie cholecystokininy, a zatem dwunastnicy/trzustki fazy trawienia białek (patrz poniżej).
należy zauważyć, że działanie pepsyny na kolagen, rodzinę białek, które owijają się i trzymają razem komórki mięśniowe, ułatwia dostęp proteazy trzustkowej do białek posiłku.
trawienie dwunastnicy i białka
gdy zawartość żołądka przechodzi do dwunastnicy, jego kwasowość stymuluje komórki S, zlokalizowane w błonie śluzowej dwunastnicy i proksymalnej części jelita cienkiego (następna część jelita cienkiego), do produkcji i uwalniania wydzieliny hormonu do krwioobiegu. Hormon powoduje wydzielanie alkalicznego soku trzustkowego, bogatego w jony wodorowęglanowe, ale ubogiego w enzymy, który przechodzi do dwunastnicy przez przewód trzustkowy. W dwunastnicy neutralizuje kwas solny wytwarzany przez żołądek, podnosząc pH do około 7 (poziomy neutralne). Wydzielina stymuluje również wydzielanie żółci i zmniejsza uwalnianie gastryny.
obecność aminokwasów w dwunastnicy stymuluje, jak wspomniano powyżej, komórki endokrynologiczne w dwunastnicy i jelicie czczym do produkcji i uwalniania cholecystokininy (CKK) do krwiobiegu. Hormon ten, między innymi, pobudza zewnątrzwydzielniczą trzustkę do wydzielania soku bogatego w enzymy (obecne w postaci zymogenów), czyli:
- Trypsynogen, chymotrypsynogen i proelastaza, endopeptydazy o różnej specyficzności substratowej w porównaniu do pepsyny, ale także wśród nich;
- prokarboksypeptydazy A i B, egzopeptydazy usuwające aminokwasy z C-końcowego końca peptydów.
dlatego w dwunastnicy znajduje się neutralne środowisko bogate w enzymy zdolne do dalszego, po aktywacji, trawienia białek. Ponadto, ponieważ proteazy mają różną specyficzność substratową, każdy peptyd wytwarzany przez enzym może być substratem innego enzymu.
w soku trzustkowym obecne są również amylazy, lipazy i nukleazy.
Aktywacja zymogenów trzustkowych
pierwszym i głównym etapem ich aktywacji jest konwersja trypsynogenu do trypsyny przez enteropeptydazę (zwaną również enterokinazą), endopeptydazę wytwarzaną przez komórki dwunastnicy po stymulacji cholecystokininą. Enteropeptydaza katalizuje rozszczepienie specyficznego wiązania peptydowego pomiędzy pozostałością lizyny a pozostałością izoleucyny trypsynogenu, uwalniając heksapeptyd. Powoduje to przegrupowanie konformacyjne białka, które je aktywuje, to znaczy powstaje trypsyna.
enzym rozszczepia wiązania peptydowe przylegające do reszt lizyny i argininy białka w celu trawienia; ponadto może aktywować chymotrypsinogen, proelastazę i prokarboksypeptydazę A i B, ale także inne cząsteczki trypsynogenu, takie jak pepsyna (autokataliza).
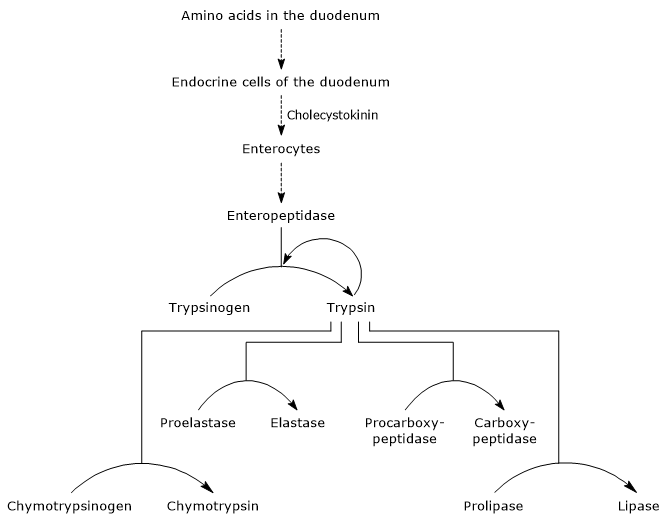
w związku z tym zdolność dwunastnicy do trawienia białek zwiększa się wraz z aktywacją zymogenów trzustkowych, wszystkie wyzwalane przez niewielką ilość enteropeptydazy.
- aktywacja chymotrypsyny do chymotrypsyny następuje poprzez różne etapy, w których biorą udział Trypsyna i sama aktywowana chymotrypsyna.
w pierwszym etapie trypsyna katalizuje rozszczepienie określonego wiązania peptydowego, co powoduje aktywację chymotrypsynogenu do π-chymotrypsyny, która jest w pełni aktywna. Następnie π-chymotrypsyna sama katalizuje uwalnianie dwóch dipeptydów z utworzeniem δ-chymotrypsyny, bardziej stabilnej postaci enzymu. δ-chymotrypsyna ulega dwóm zmianom konformacyjnym, z których pierwsza prowadzi do powstania κ-chymotrypsyny, a druga α-chymotrypsyny, ostatecznej aktywnej postaci enzymu.
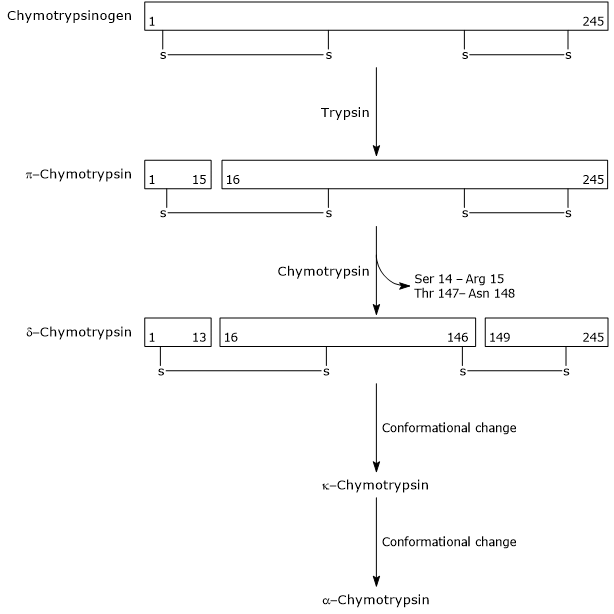
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
elastaza, która jest mniej specyficzna niż inne hydrolazy trawienne, katalizuje rozszczepienie wiązań peptydowych sąsiadujących z aminokwasami takimi jak glicyna, alanina i seryna. - Prokarboksypeptydaza
Prokarboksypeptydaza a jest aktywowana do karboksypeptydazy a; proteaza rozszczepia wiązania peptydowe przylegające do aminokwasów o rozgałęzionych lub aromatycznych łańcuchach bocznych, takich jak fenyloalanina i walina.
Prokarboksypeptydaza B jest aktywowana do karboksypeptydazy B, specyficznej dla aminokwasów o podstawowych łańcuchach bocznych, takich jak lizyna i arginina.
wyżej wymienione proteazy, w przeciwieństwie do pepsyny, mają optymalne pH działania w zakresie od 7 do 8, czyli obojętne lub słabo zasadowe.
inhibitor trypsyny trzustkowej
istnieje „dodatkowy” system ochrony przed śródkretyczną aktywnością trypsyny: synteza inhibitora zwanego „inhibitorem trypsyny trzustkowej”. Cząsteczka, obecna w granulkach zymogenu trzustkowego, jest zdolna do bardzo ścisłego wiązania aktywnego miejsca enzymu inaktywującego go. W ten sposób blokuje się aktywność jakiejkolwiek trypsyny wynikającą z przedwczesnej aktywacji trypsynogenu, zapobiegając sytuacji, w której kilka aktywowanych cząsteczek aktywuje wszystkie zymogeny trzustkowe.
u roślin istnieje wiele cząsteczek o podobnej aktywności. Przykładem jest inhibitor trypsyny Kunitza, białko występujące głównie w soi, które tworzy bardzo stabilny kompleks z aktywnym miejscem trypsyny.
ponieważ wyżej wymienione proteazy mają odrębną specyficzność substratową, działając na wiązania peptydowe przylegające do różnych aminokwasów, każdy peptyd wytwarzany przez proteazę może być substratem innego. W ten sposób częściowo strawione białka, które wchodzą do dwunastnicy, są skutecznie hydrolizowane do wolnych aminokwasów i peptydów o 2-8 reszt. Peptydy te są substratami aminopeptydaz wydzielanych z enterocytów i związanych z ich mikrowilami.
występują również Dipeptydazy.
należy zauważyć, że te same proteazy są w końcu trawione, kończąc proces.
znaczenie i skuteczność enzymów proteolitycznych w trawieniu białek jelitowych można zrozumieć z tego przykładu. Jeśli in vitro chcesz hydrolizować białko do jego składowych aminokwasów, konieczne jest użycie silnego i stężonego kwasu jako katalizatora i podgrzanie próbki w temperaturze 105 ° C przez noc. W jelitach ten sam wynik uzyskuje się w ciągu kilku godzin, działając najpierw w stosunkowo kwaśnym środowisku żołądka, a następnie w łagodnych zasadowych warunkach dwunastnicy, w temperaturze 37 °C.
uwolnione aminokwasy wraz z di – i tri-peptydami są wchłaniane przez enterocyty. Di-i tri-peptydy są zwykle hydrolizowane do składowych aminokwasów w enterocytach, co wyjaśnia, dlaczego praktycznie tylko wolne aminokwasy są obecne w krążeniu wrotnym.
Bender D. A. Benders’ dictionary of nutrition and food technology. VIII edycja. Wydawnictwo Woodhead. Oxford, 2006
Bender D. A. Introduction to nutrition and metabolism. III edycja. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L., and Stryer L. Biochemia. V edycja. W. H. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. Essentials of medical biochemistry: with clinical cases. IV edycja. Academic Press, 2015
Cozzani I. and Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Zasady biochemii. IV edycja. W. H. Freeman and Company, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M. D., Glew R. H. Medical Biochemistry: Human metabolism in health and disease. John Wiley &Sons, INC., Publikacja, 2009
Stipanuk M. H., Caudill M. A. biochemiczne, fizjologiczne i molekularne aspekty żywienia człowieka. III edycja. Elsevier health sciences, 2013