digestia proteinelor: pași, enzime și hormoni
organismul necesită proteine și, în special, aminoacizii esențiali conținuți în ele. Aportul zilnic recomandat pentru un subiect adult sănătos este de 0,85 g/kg greutate corporală, deci pentru o persoană de 70 kg este de aproximativ 60 g, dar adesea în dieta tipică occidentală aportul este mai mare de 100 g/zi.
În plus față de proteinele alimentare, organismul digeră, de asemenea, 50-100 g de proteine endogene secretate sau pierdute în lumenul tractului gastro-intestinal și care rezultă din:
- salivă;
- suc gastric;
- enzime pancreatice și alte secreții;
- celule intestinale care se desprind;
- proteine care trec în lumenul intestinal din sânge.
acest amestec este digerat și absorbit eficient în duoden, prima și cea mai scurtă parte a intestinului subțire, cu o pierdere zilnică prin fecale egală cu aproximativ 1,6 g de azot, echivalent cu 10 g de proteine. Cea mai mare parte a azotului pierdut este utilizată de microflora din colon pentru creșterea sa și, prin urmare, se găsește în fecale ca parte a masei bacteriene.
cuprins
- enzime Digestive
- rolul de gătit și de mestecat de alimente
- etapele de proteine digestie
- stomac și proteine digestie
- proteine digestie și pepsină
- duoden și proteine digestie
- activarea zymogens pancreatice
- Pancreatic inhibitor de tripsină
- stomac și proteine digestie
enzime digestive
digestia proteinelor apare ca urmare a hidrolizei legăturilor peptidice care leagă aminoacizii individuali din lanțul polipeptidic. Aceste reacții sunt catalizate de enzime numite proteaze.
proteazele intestinale, specifice lanțului lateral de aminoacizi, sunt hidrolaze care pot fi împărțite în două clase:
- endopeptidaze, care hidrolizează legăturile peptidice din lanțul polipeptidic și sunt produse de stomac și de pancreasul exocrin;
- exopeptidaze, care pot fi împărțite în două grupe:
carboxipeptidaza, care îndepărtează aminoacizii din capătul C-terminal și sunt produși de produs de pancreasul exocrin;
aminopeptidaza, care acționează la capătul N-terminal, și sunt produse de enterocite.

aceste enzime sunt sintetizate și secretate într-o formă inactivă, numite zymogeni sau proenzime.
în interiorul celulei, chimogenii sunt depozitați în interiorul granulelor cu membrană numite granule de zymogen. Când celula este stimulată de semnalul specific, membrana granulară se fuzionează cu membrana plasmatică și zimogenii sunt eliberați prin exocitoză.
aceste proteaze sunt sintetizate într-o formă inactivă pentru a evita ca, înainte de a fi secretate, să se digere și/sau proteine tisulare. Ceea ce se întâmplă este că situsul activ al enzimei este „mascat” și numai după activare proteina poate acționa asupra substratului. Activarea este rezultatul scindării, catalizată de o enzimă specifică, a uneia sau mai multor legături peptidice specifice, cu eliberarea unuia sau mai multor segmente ale lanțului polipeptidic. Aceasta permite moleculei să-și asume o conformație tridimensională în care site-ul activ este liber și configurat corect.
chiar și acumularea lor în granule este un sistem de protecție: le izolează de celelalte molecule prezente în celulă.
majoritatea proteinelor din conformația lor nativă sunt rezistente la acțiunea proteazelor. Aceasta este o consecință a structurii lor secundare și terțiare sau native care maschează multe legături cu acțiunea enzimelor. Aceste structuri sunt stabilizate prin legături covalente, cum ar fi punțile disulfidice dintre reziduurile de cisteină și forțele necovalente, cum ar fi interacțiunile ionice, legăturile de hidrogen și forțele van der Waals.
pentru o digestie adecvată a proteinelor, este esențial ca legăturile peptidice să fie cât mai accesibile acțiunii proteazelor intestinale. Acest lucru se realizează în afara corpului prin gătirea alimentelor și în interiorul corpului prin mediul acid din stomac.
rolul gătirii și mestecării alimentelor
gătirea alimentelor, atunci când nu este excesivă, facilitează digestia proteinelor.
in ce fel?
ca toate moleculele, de asemenea, proteinele nu sunt nemișcate, ci vibrează. Pe măsură ce temperatura crește, proteinele vibrează la o amplitudine mai mare, până la distrugerea legăturilor necovalente care contribuie la menținerea structurii native. Prin urmare, apare o schimbare conformațională a proteinei, adică molecula este denaturată. Acest lucru poate face legăturile peptidice interne mai accesibile acțiunii enzimelor digestive.
chiar și mestecarea și insalivarea alimentelor omogenizează și umidifică componentele solide ale alimentelor în sine, facilitând digestia gastrică și intestinală mică.
etapele digestiei proteinelor
două etape sunt implicate în digestia proteinelor: prima apare în stomac și cealaltă în în duoden, prima parte a intestinului subțire.
digestia stomacului și a proteinelor
digestia proteinelor începe în stomac și aceasta este o „etapă de pregătire” în comparație cu evenimentele care apar în duoden.
prezența alimentelor în stomac stimulează celulele G ale mucoasei antrumului gastric și a duodenului proximal pentru a produce și elibera hormonul gastrină în sânge. Hormonul stimulează celulele parietale ale glandelor gastrice adecvate, localizate mai ales în partea de jos a organului, pentru a produce și secreta acid clorhidric în stomac (celulele parietale produc și factorul intrinsec, o proteină care leagă vitamina B12, prevenind distrugerea acesteia și permițând absorbția acesteia).
în glandele gastrice corespunzătoare ați găsit, de asemenea:
- celule mucoase ale gâtului, care produc mucus;
- celule principale, care eliberează pepsinogen.
toate aceste substanțe, împreună cu altele, cum ar fi ionii de potasiu și lipaza gastrică, sunt prezente în sucul gastric, care are un pH care variază între 1 și 2,5.datorită pH-ului său scăzut, sucul gastric are o acțiune antiseptică, ucigând majoritatea bacteriilor și a altor celule străine și un efect de denaturare, deoarece rupe legăturile necovalente care mențin structura nativă a proteinelor. Acest efect de denaturare facilitează accesul proteazei intestinale la legăturile peptidice, cum ar fi încălzirea în timpul gătitului. Unele proteine bogate în legături disulfidice, cum ar fi keratinele, sunt rezistente la denaturare prin pH scăzut și, prin urmare, dificil de digerat. Dimpotrivă, majoritatea proteinelor globulare sunt aproape complet hidrolizate în aminoacizi constituenți.
în cele din urmă, pH-ul scăzut al sucului gastric activează pepsinogenul, un zimogen, la pepsină, prima enzimă implicată în digestia proteinelor.
digestia proteinelor și pepsina
există diferite izoenzime ale pepsinogenului, cum ar fi tipul I, sintetizat de celulele corpului și fundul stomacului și tipul II care este produs în toate regiunile organului. Toate izoenzimele sunt transformate în enzima activă. Activarea are loc prin autocataliză, la valori ale pH-ului sub 5, printr-un proces intramolecular constând în hidroliza unei legături peptidice specifice și eliberarea unei peptide mici din capătul N-terminal al proenzimei. Această peptidă rămâne legată de enzimă și continuă să acționeze ca un inhibitor până când pH-ul scade sub 2 sau până când este degradat în continuare de pepsină în sine. Deci, odată ce se formează o anumită pepsină, aceasta activează rapid alte molecule de pepsinogen.
pepsina, o endopeptidază cu un pH optim de activitate la 1,6, hidrolizează 10-20% din proteinele din masă. Multe enzime digestive sunt capabile să acționeze pe o gamă largă de substraturi, iar pepsina nu face excepție, catalizând scindarea legăturilor peptidice adiacente reziduurilor de aminoacizi, cum ar fi leucina și fenilalanina, tirozina și triptofanul (aminoacizi aromatici). Se produce un amestec de peptide de dimensiuni mari și câțiva aminoacizi liberi.
acțiunea pepsinei este importantă nu atât pentru contribuția sa directă la digestia proteinelor, adică modestă, ci pentru eliberarea peptidelor și aminoacizilor care, la nivel duodenal, stimulează secreția de colecistochinină și, prin urmare, faza duodenală/pancreatică a digestiei proteinelor (vezi mai jos).trebuie remarcat faptul că acțiunea pepsinei asupra colagenului, o familie de proteine care înfășoară și țin împreună celulele musculare, facilitează accesul proteazei pancreatice la proteinele din masă.
duoden și digestia proteinelor
când conținutul gastric trece în duoden, aciditatea acestuia stimulează celulele S, localizate în mucoasa duodenală și în partea proximală a jejunului (următoarea parte a intestinului subțire), pentru a produce și elibera hormonul secretină în sânge. Hormonul provoacă secreția unui suc pancreatic alcalin, bogat în ioni de bicarbonat, dar sărac în enzime, care trece în duoden prin conducta pancreatică. În duoden, neutralizează acidul clorhidric produs de stomac, ridicând pH-ul la aproximativ 7 (niveluri neutre). Secretina stimulează, de asemenea, secreția biliară și reduce eliberarea gastrinei.
prezența aminoacizilor în duoden stimulează, așa cum sa menționat mai sus, celulele endocrine din duoden și jejun pentru a produce și elibera colecistokinina (CKK) în sânge. Hormonul, printre alte funcții, stimulează pancreasul exocrin să secrete un suc bogat în enzime (prezent ca chimogeni), adică:
- tripsinogen, chimotripsinogen și proelastază, endopeptidaze cu o specificitate diferită a substratului față de pepsină, dar și printre acestea;
- procarboxipeptidaza a și B, exopeptidaze care elimină aminoacizii din capătul C-terminal al peptidelor.
prin urmare, în duoden există un mediu neutru bogat în enzime capabile să continue, odată activată, digestia proteinelor. Mai mult, deoarece proteazele au specificitate diferită a substratului, fiecare peptidă produsă de o enzimă poate fi substrat al unei alte enzime.
în sucul pancreatic, sunt prezente și amilaza, lipaza și nucleaza.
activarea zimogenilor pancreatici
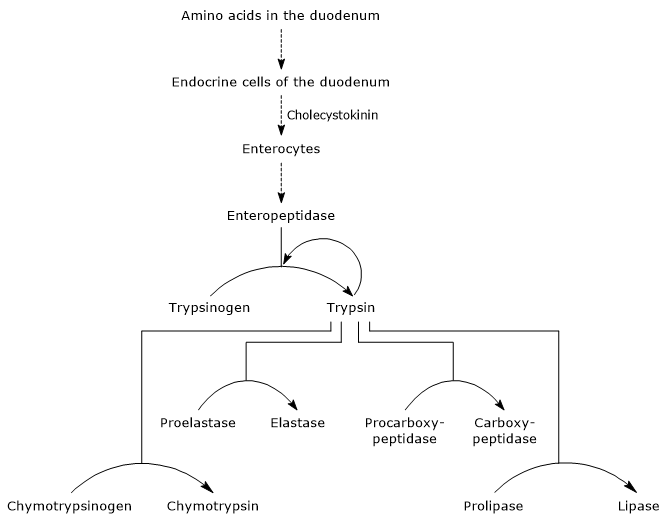
primul pas principal în activarea lor este conversia tripsinogenului în tripsină prin enteropeptidază (numită și enterokinază), o endopeptidază produsă de celulele duodenului după stimularea colecistokininei. Enteropeptidaza catalizează scindarea unei legături peptidice specifice între un reziduu de lizină și un reziduu de izoleucină al tripsinogenului, cu eliberarea unei hexapeptide. Aceasta determină o rearanjare conformațională a proteinei care o activează, adică se formează tripsină.
enzima scindează legăturile peptidice adiacente reziduurilor de lizină și arginină de proteine pentru digerare; în plus, poate activa chimotripsinogenul, proelastaza și procarboxipeptidaza a și B, dar și alte molecule de tripsinogen, cum ar fi pepsina (autocataliza).
prin urmare, capacitatea duodenului de a digera proteinele crește odată cu activarea zimogenilor pancreatici, toate declanșate de o cantitate mică de enteropeptidază.
- activarea chimotripsinogenului la chimotripsină are loc prin diferite etape la care participă tripsina și chimotripsina activată.
în prima etapă, tripsina catalizează scindarea unei legături peptidice specifice, ceea ce determină activarea chymotrypsinogenului la cimotripsina, care este pe deplin activă. Apoi, în sine, cimotripsina-cimotripsina catalizează eliberarea a două dipeptide cu formarea cimotripsinei-cimotripsinei, o formă mai stabilă a enzimei. XCT-chimotripsina suferă două modificări conformaționale, dintre care prima conduce la formarea xtct-chimotripsina, iar a doua a xtct-chimotripsina, forma activă finală a enzimei.
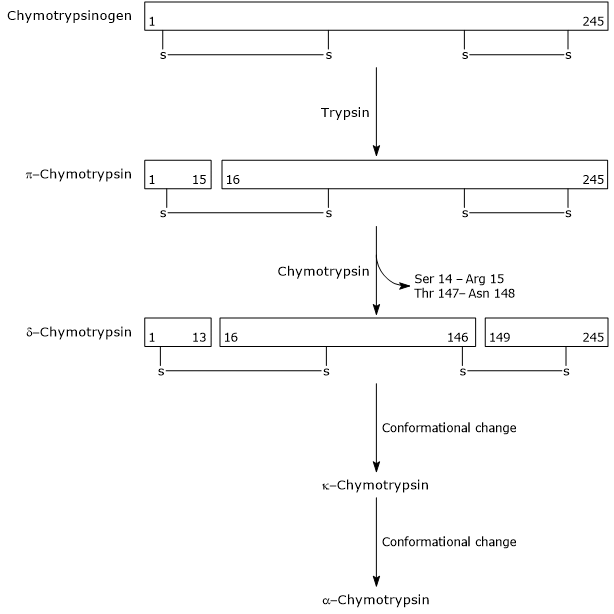
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.elastaza, care este mai puțin specifică decât celelalte hidrolaze digestive, catalizează scindarea legăturilor peptidice adiacente aminoacizilor precum glicina, alanina și Serina.Procarboxipeptidaza A este activată la carboxipeptidaza A; proteaza scindează legăturile peptidice adiacente aminoacizilor cu lanțuri laterale ramificate sau aromatice, cum ar fi fenilalanina și valina.Procarboxipeptidaza B este activată la carboxipeptidaza B, specifică aminoacizilor cu lanțuri laterale bazice, cum ar fi lizina și arginina.proteazele menționate mai sus, spre deosebire de pepsină, au un pH optim de acțiune variind de LA7 la 8, adică neutru sau slab alcalin.
inhibitor de tripsină pancreatică
există un sistem de protecție „suplimentar” împotriva activității tripsinei intrapancreatice: sinteza unui inhibitor numit „inhibitor de tripsină pancreatică”. Molecula, prezentă în granulele de zymogen pancreatic, este capabilă să lege foarte strâns locul activ al enzimei care o inactivează. În acest fel, activitatea oricărei tripsine care rezultă dintr-o activare prematură a tripsinogenului este blocată, prevenind o situație în care câteva molecule activate activează toți zimogenii pancreatici.
în plante, există multe molecule cu activitate similară. Un exemplu este inhibitorul de tripsină Kunitz, o proteină care se găsește în principal în soia, care formează un complex foarte stabil cu situsul activ al tripsinei.deoarece proteazele menționate mai sus au o specificitate distinctă a substratului, acționând asupra legăturilor peptidice adiacente diferiților aminoacizi, fiecare peptidă generată de o protează poate fi substrat al alteia. În acest fel, proteinele parțial digerate care intră în duoden sunt hidrolizate eficient în aminoacizi liberi și peptide de 2-8 reziduuri. Aceste peptide sunt substraturi ale aminopeptidazelor secretate din enterocite și asociate cu microvilii lor.
Dipeptidaza sunt de asemenea prezente.
trebuie remarcat faptul că aceleași proteaze sunt digerate în cele din urmă, încheind procesul.importanța și eficacitatea enzimelor proteolitice în digestia proteinelor intestinale pot fi înțelese din acest exemplu. Dacă in vitro doriți să hidrolizați o proteină în aminoacizii săi constituenți, este necesar să utilizați un acid puternic și concentrat ca catalizator și să încălziți proba la 105 centi C peste noapte. În intestin același rezultat se obține în câteva ore, funcționând mai întâi în mediul relativ acid al stomacului și apoi în condițiile alcaline ușoare ale duodenului, la 37 C.aminoacizii eliberați, împreună cu di – și tri-peptidele, sunt absorbiți de enterocite. Di-și tri-peptidele sunt de obicei hidrolizate în aminoacizi constituenți în enterocite și acest lucru explică de ce practic numai aminoacizii liberi sunt prezenți în circulația portalului.
Bender D. A. dicționarul Benders de nutriție și Tehnologie Alimentară. Ediția a 8-a. Editura Woodhead. Oxford, 2006
Bender D. A. Introducere în nutriție și metabolism. Ediția a 3-a. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L. și Stryer L. Biochimie. Ediția a 5-a. W. H. Freeman and Company, 2002
Bhagavan N. V., ha C-E. esențiale ale biochimiei medicale: cu cazuri clinice. Ediția a 4-a. Academic Press, 2015
Cozzani I. și Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Principiile biochimiei. Ediția a 4-a. W. H. Freeman și compania, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal MD, Glew R. H. Biochimie medicală: metabolismul uman în sănătate și boli. John Wiley & Sons, INC., Publicație, 2009
Stipanuk M. H., Caudill M. A. Aspecte biochimice, fiziologice și moleculare ale nutriției umane. Ediția a 3-a. Elsevier științe ale sănătății, 2013