Werfen Sie einen Blick auf die jüngsten Artikel
Zusammenfassung
Low-Output-Herzinsuffizienz (LoHF) ist eine seltene Form der Herzinsuffizienz (HF), aber eine, die sehr fortgeschrittene HF signalisiert. Es ist mit einer bedrohlichen Prognose sowie einer erheblichen Morbidität und Mortalität verbunden. LoHF bleibt jedoch weitgehend unterforscht. Die traditionelle Beschreibung von HF konzentrierte sich auf kongestive Herzinsuffizienz (CHF), die durch ein niedriges Herzzeitvolumen gekennzeichnet ist und von einer pulmonalen / peripheren Stauung begleitet wird. Dieser Fokus trug zur Unterbewertung von LoHF-Patienten bei, die wenig oder keine Anzeichen einer Stauung aufweisen. Darüber hinaus haben LoHF-Patienten keine nachgewiesene Therapie und die Auswahl einer geeigneten Behandlung hängt von der individuellen Pathophysiologie und der zugrunde liegenden Ätiologie ab. LoHF-Patienten weisen eine heterogene Ätiologie und Pathophysiologie auf, was die Bedeutung eines eingehenden Verständnisses der klinischen Merkmale, der Diagnose und des klinischen Managements hervorhebt, das die Grundlage der vorliegenden Überprüfung bildet.
Schlüsselwörter
Low-Output-Herzsyndrom, Low-Output-Herzinsuffizienz, Low-Output-Zustand
Einführung
Trotz bemerkenswerter Fortschritte bei medizinischen und chirurgischen Therapien stellt die effektive Behandlung von Herzinsuffizienz (HF) die Gesundheitsdienstleister weiterhin vor erhebliche Herausforderungen. Die Herausforderung spiegelt sich in hohen Raten von HF-bedingten Krankenhausrückübernahmen sowie einer erhöhten Mortalität und Morbidität wider . Ein Teil der Herausforderung ist die sehr heterogene Ätiologie, Pathophysiologie und klinische Präsentation verschiedener Formen von HF, in denen einige HF-Formen haben einen Mangel an klinischen Studiendaten und folglich ein begrenztes Verständnis. Insbesondere die traditionelle Beschreibung von HF war fast gleichbedeutend mit kongestiver Herzinsuffizienz (CHF) Der Begriff CHF schließt jedoch eine Minderheit von HF-Patienten aus, die wenig oder keine nachweisbaren Symptome einer pulmonalen und / oder peripheren Stauung aufweisen . Low-Output-HF (LoHF) wurde auch mit einer ominösen Prognose in Verbindung gebracht und signalisiert sehr fortgeschrittene HF. Darüber hinaus unterstützen symptomatische und pathophysiologische Unterschiede bei CHF und LoHF die Notwendigkeit unterschiedlicher klinischer Managementansätze . Trotz dieser Unterschiede, traditionelle HF-Therapien wurden auf alle Formen von HF einschließlich CHF und LoHF verallgemeinert, Schaffung eines klinischen Bedarfs zum Verständnis der Pathophysiologie, Diagnose und klinisches Management von LoHF. In diesem Artikel aggregieren wir veröffentlichte Evidenz zu LoHF in Bezug auf Epidemiologie, Ätiologie, Pathophysiologie, Diagnose und klinisches Management. Ziel ist es, das Wissen über den klinischen Status von LoHF zu verbessern sowie das klinische Management von HF im Allgemeinen zu verbessern.
Definition
Herzinsuffizienz ist ein komplexes klinisches Syndrom, das durch strukturelle und/ oder funktionelle Myokarddefekte gekennzeichnet ist, die zu einer beeinträchtigten ventrikulären Füllung oder Ejektion führen . Die Komplexität des Syndroms zeigt sich in seinen heterogenen Klassifikationen: rechts-, links- oder zweiventrikulär basierend auf dem Defektort; akut oder chronisch basierend auf dem Zeitpunkt des Auftretens; konservierte, grenzwertige oder reduzierte Ejektionsfraktion basierend auf dem Funktionsstatus; niedrige oder hohe Leistung basierend auf dem Herzzeitvolumen (CO) und Vorwärts- oder Rückwärtsfehler basierend auf der Richtung des Blutflusses. Jede dieser Klassifikationen ist für die Diagnose und Behandlung von HF von Bedeutung . Trotz der verschiedenen Klassifikationen wurde der Begriff CHF traditionell synonym mit HF verwendet, der LoHF jedoch aufgrund mehrerer symptomatischer und pathophysiologischer Unterschiede nicht ausreichend beschreibt.
LoHF, auch bekannt als Low CO bei akuter dekompensierter HF, beschreibt eine Hochschärfe Form von HF gekennzeichnet durch verringerte vorwärts CO (Herzindex < 2.0 L/ min/m2 und systolischer Blutdruck < 90 mmHg) und Endorganhypoperfusion mit geringen oder keinen Anzeichen einer Lungenstauung . LoHF unterscheidet sich von CHF, die HF beschreibt, die durch reduziertes CO gekennzeichnet ist, was zu einer pulmonalen und peripheren Stauung führt, die zu Dyspnoe bzw. peripherem Ödem führt . Die Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) von 2005 zur Diagnose und Behandlung von HF legen ein Kontinuum vom Syndrom mit niedrigem Herzzeitvolumen (Low Cardiac Output Syndrome, LCOS) über LoHF bis hin zum kardiogenen Schock nahe. Die ESC-Richtlinien definieren einen kardiogenen Schock als Nachweis einer durch HF induzierten Gewebeperfusion nach Korrektur der Vorlast, die durch systolischen Blutdruck < 90 mmHg oder einen Abfall des mittleren arteriellen Drucks > 30 mmHg; Urinausstoß < 0,5 ml/kg/ h; Pulsfrequenz > 60 Schläge pro Minute (bpm) mit oder ohne Anzeichen einer Überlastung . LCOS hingegen ist bei postoperativen HF-Patienten häufig und definiert als die Notwendigkeit einer postoperativen intraaortalen Ballonpumpe oder einer inotropen Unterstützung für mehr als 30 Minuten in einer Akutversorgung .
Epidemiologie
Die genaue Prävalenz und Inzidenz von LoHF in der Allgemeinbevölkerung ist völlig unbekannt. Derzeit liegen keine populationsbasierten epidemiologischen Daten speziell für LoHF vor. Die einzigen verfügbaren Daten stammen aus einzelzentrischen klinischen Studien, in denen eine ausgewählte Population von HF-Patienten untersucht wurde, die sich einer Herzoperation unterzogen haben. Im Jahr 1975, Parr et al. machte die wegweisende Beschreibung der klinischen Entität von LCOS und berichtete über eine Inzidenz von 25% bei Kindern, die sich einer Herzoperation unterzogen hatten, basierend auf einem verringerten CO, definiert als CI < 2,0 L/min/m2. Zwei Jahrzehnte später, Wernovsky et al. zeigte die gleiche Inzidenz von postoperativen LCOS bei Patienten, die sich einer arteriellen Schalteroperation unterzogen hatten, die innerhalb von 6-18 Stunden nach der Operation auftrat. Viele neuere klinische Studien berichten von einer großen Variation der Prävalenz von 3, 6% (Männer) und 5, 9% (Frauen) auf 9, 1% und 41% und einer Inzidenz von 14, 7% . In einer aktuellen langfristigen (zwanzigjährigen: 1990-2009) prospektive klinische Studie mit 25.176 Patienten mit konsekutiver Koronararterien-Bypass-Transplantation (CABG), Algarni et al. berichtet Die Prävalenz von postoperativen LCOS sank signifikant von 9,1% (1990-1994) auf 2,4% (2005-2009) .
Ätiologie
Die Ätiologie von LoHF ist multifaktoriell. Im Allgemeinen ist es eine Folge der Dysfunktion des linken Ventrikels (LV), des rechten Ventrikels (RV) oder des systemischen Ventrikels (Einzelventrikelanatomie) und kann eine oder beide systolische und / oder diastolische Dysfunktion umfassen . Störungen der ventrikulären Füllung oder des Ausstoßens führen zu LoHF, einer häufigen Komplikation bei Patienten, die sich einer Herzoperation unterzogen haben oder sich in einem kardiogenen Schock befinden . Es kann sich bei Patienten mit chronischer HF als akute Verschlechterung darstellen oder es kann sich um eine vorübergehende und reversible Episode mit Auflösung des akuten Auslösers handeln. Es ist ein klinisches Syndrom, das als letzter Weg einer Vielzahl von Krankheiten angesehen wird, die die Herzfunktion beeinflussen. Es reicht nicht aus, LoHF zu diagnostizieren, die zugrunde liegende Ursache oder der Auslöser muss ebenfalls ermittelt und wenn möglich behandelt werden . Tabelle 1 enthält eine Zusammenfassung der Zustände, die bei HF-Patienten zu einem Zustand mit niedrigem Output führen.
Tabelle 1. Ätiologie des Low-Output-Zustands durch Pathophysiologie
|
Mechanismen |
Ursächliche Zustände |
|
Verlust der myokardialen Kontraktilität |
Koronararterie Kardiomyopathie, Myokarditis, dekompensierte chronische HF, Postherzchirurgie, Toxine, Ernährung (Fettleibigkeit), infiltrative Erkrankungen, Nierenversagen im Endstadium, Chagas-Krankheit oder HIV-Infektion |
|
Beeinträchtigte ventrikuläre Füllung oder Ausstoß |
Perikarditis, Perikarderguss, Herztamponade, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
Das aktuelle Verständnis der Pathophysiologie von LoHF stützt sich weitgehend auf die Evidenz aus klinischen Studien an postoperativen CABG-Patienten . Das pathologische Kennzeichen ist übermäßig deprimiert, begleitet von einer Endorganhypoperfusion. Physiologisch fungiert das Herz als Pumpe, um sauerstoffreiches Blut in ausreichenden Mengen zu verteilen, um den Stoffwechselbedarf des Gewebes zu decken. Da der Stoffwechselbedarf unter normalen und stressigen Situationen variiert, variiert auch CO, um diese dynamische Nachfrage zu befriedigen . Die diastolische Phase des Herzzyklus ist bei LoHF-Patienten kritisch, da während der ventrikulären Relaxation eine Koronarfüllung auftritt, um eine myokardiale Sauerstoffversorgung bereitzustellen . Die Herzfrequenz (HR) ist auch für die Diastole von Bedeutung, da eine zu schnelle HR das Herz daran hindert, eine vollständige Myokardrelaxation und -perfusion zu erreichen. Somit resultiert eine Herzfunktionsstörung aus einer strukturellen (Restherzanomalie) oder funktionellen Herzstörung (Störungen der ventrikulären Füllung oder Entleerung oder eines erhöhten systemischen Gefäßwiderstands ).
Pathophysiologisch ist CO abhängig von der HR und dem Schlagvolumen (SV) (CO = HR * SV). Das Schlagvolumen wiederum ist das Nettoprodukt von drei miteinander verbundenen Zirkulationsvariablen: Vorlast, Nachlast und Kontraktilität. Wenn eine oder mehrere dieser Komponenten beeinträchtigt sind, kann sich ein Zustand mit niedrigem Herzzeitvolumen entwickeln . Darüber hinaus beeinflussen diese Komponenten sowohl die systolische als auch die diastolische Phase des Herzzyklus verursacht LV / RV systolische Dysfunktion und / oder diastolische Dysfunktion, auch bekannt als HF mit erhaltener Ejektionsfraktion (Abbildung 1). Andere Erkrankungen wie Herzklappenerkrankungen, pulmonale Hypertonie (PH), mechanische Klappenfunktionsstörungen und Atemstillstand können die Entwicklung von LoHF auslösen oder verschlimmern .
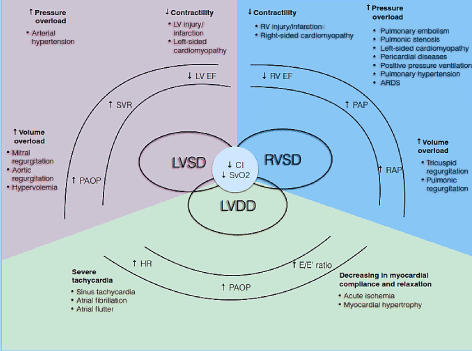
Abbildung 1. Pathophysiologische Mechanismen der Low-Output-Herzinsuffizienz
Häufige Ursachen und typische; Symptome von LoHF sind enthalten. Die wichtigsten pathophysiologischen Mechanismen der LoHF ist ventrikuläre Dysfunktion: Systolische und / oder diastolische LV-Dysfunktion und systolische RV-Dysfunktion, die alle gemeinsame pathologische Merkmale aufweisen reduzierter Herzindex (CI) und reduzierte gemischte venöse Sauerstoffsättigung (SvO2). Die systolische Dysfunktion von LV und RV resultiert aus einer erhöhten Drucküberlastung, einer erhöhten Volumenüberlastung und einer verminderten Kontraktilität, während die diastolische Dysfunktion von LV aus einer schweren Tachykardie und einer verminderten myokardialen Compliance und Entspannung resultiert. Angepasst von Lomivorotov et al. 2017, S. 293
LV ystolische Dysfunktion
Linksventrikuläre (LV) systolische Dysfunktion (oder depressive LV-Ejektionsfraktion ) ist der häufigste pathophysiologische Mechanismus bei LoHF-Patienten. Zirkulationsvariablen, die die systolische LV-Funktion beeinflussen, sind Vorlast, Nachlast und Kontraktilität . Im Allgemeinen ist die systolische LV-Dysfunktion eine Folge des Verlusts oder der Verringerung funktioneller Kardiomyozyten infolge einer Nekrose aufgrund einer gestörten Koronarzirkulation und Ischämie, einer Reperfusionsverletzung oder des weniger verstandenen natürlichen Phänomens der Kardiomyozyten-Apoptose . Der Verlust von funktionellen Kardiomyozyten kann vorübergehend sein, wie während der myokardialen Betäubung definiert als ein lebensfähiges Myokard, das durch koronare Reperfusion geborgen wird und eine verlängerte postischämische Dysfunktion nach der Reperfusion aufweist . Der Verlust von funktionellen Kardiomyozyten kann auch bei Erkrankungen wie Infektionen, Tachykardie, Klappenerkrankungen, Stoffwechselstörungen wie Azidose, Hypoglykämie, Hypokalzämie, Exposition gegenüber kardialen Umweltgiften und -chemikalien, idiopathischer dilatativer Kardiomyopathie (DCM) refraktär sein; und genetische Störungen wie familiäre DCM, hypertrophe Kardiomyopathie und Muskeldystrophien . Eine beeinträchtigte kardiale Reaktion auf die Vorbelastung führt zu einer dramatischen Abnahme der CO- und Sauerstoffzufuhr zu anderen wichtigen Körperorganen, erhöhtem Vorhofdruck, Kapillarkeildruck und kardiogenem Lungenödem. Obwohl sich kompensatorische Veränderungen im LV an einen relativ hohen systemischen arteriellen Druck anpassen, kann ein signifikanter Anstieg der Nachlast eine systolische LV-Dysfunktion hervorrufen .
LV-diastolische Dysfunktion
Obwohl gelegentlich, kann sich LoHF bei Patienten mit LV-diastolischer Dysfunktion mit erhaltener LVEF entwickeln. Der Zustand resultiert aus der Unfähigkeit der Ventrikelkammer, sich trotz normaler Vorlast mit einem ausreichenden Blutvolumen zu füllen, was sich als diastolische Dysfunktion darstellt . Grunderkrankungen wie schwere Tachykardie, verminderte Myokardkompatibilität oder abnormale ventrikuläre Entspannung beeinträchtigen die Entspannung und Füllung des LV während der Diastolenphase des Herzzyklus. Auf Kardiomyozytenebene sind diese Zustände mit einer Calciumentfernung aus dem Cytosol und einer Calciumhomöostase, der Angemessenheit einer Kreuzbrückenablösung und einer intrinsischen funktionellen Störung des Zytoskelettelements verbunden . Eine Kreuzbrückenablösung kann zu einer verzögerten isovolumischen Relaxationszeit beitragen, was zu einem verringerten LV-Schlagvolumen führt, insbesondere bei höheren HR . Die LV-Relaxation hängt auch von der sarkoplasmatischen retikulären Calciumionen-Wiederaufnahme und der Stickoxidsignalisierung ab, die auch die Ablösung der Querbrücken erleichtern. Da der Prozess der Kreuzbrückenablösung energieaufwendig ist, kann er ein Defizit an myokardialer Energie verursachen und folglich die LV-Myokardrelaxation verlangsamen .Obwohl die diastolische Dysfunktion ein weit verbreitetes Phänomen ist, das bei bis zu 70% der postoperativen Herzpatienten beobachtet wird , reicht die diastolische Dysfunktion allein nicht aus, um die Entwicklung einer akuten HF zu erklären. Bei anderen klinischen Zuständen wie Vorhofflimmern (AF), beeinträchtigter Koronardurchblutung und arterieller Hypertonie kann eine diastolische Dysfunktion zu einem dekompensierten Zustand führen und daher als frühes Anzeichen einer Myokardischämie angesehen werden . Die dynamische Beziehung zwischen den diastolischen und systolischen LV-Funktionen trägt ebenfalls zur diastolischen Dysfunktion bei LoHF-Patienten bei. Die Stimulation von inotropem Katecholamin beeinflusst sowohl die Diastole als auch die Systole und kann die diastolische Dysfunktion verstärken. Eine depressive LVEF führt zu einer Erhöhung des endsystolischen Volumens und verlängert die diastolische Phase des Herzzyklus .
RV-Dysfunktion
Bei LoHF, insbesondere nach einer Koronararterienoperation, umfassen die hauptsächlichen pathophysiologischen Mechanismen der RV-Dysfunktion eine erhöhte Vorlast, eine erhöhte Nachlast, eine beeinträchtigte Perfusion der rechten Koronararterie und eine verminderte Kontraktilität . Im Gegensatz zur linken Koronararterie erfolgt die Perfusion der rechten Koronararterie sowohl während der Diastole als auch während der Systole. Das Vorhandensein von PH verursacht einen Anstieg des RV-Drucks, der zu einer verminderten rechten Koronararterienperfusion führt, was die Bedeutung für die Bereitstellung einer optimalen linken und rechten Koronarzirkulation erklärt . Bei Patienten, die sich einer Koronararterienoperation unterzogen haben, kann sich eine RV-Dysfunktion als Ergebnis einer Kombination von Mechanismen entwickeln. Perioperative RV-Ischämie und Infarkt sind die Hauptursachen für eine beeinträchtigte RV-Kontraktilität. Trikuspidal- oder Pulmonalinsuffizienz sind häufige Ursachen für eine erhöhte Volumenvorlast, während linksseitige Klappenerkrankungen oder Kardiomyopathie, PH-Wert oder Lungenembolie (PE), akutes Atemnotsyndrom und Überdruckbeatmung häufige Ursachen für Drucküberlastung sind . Da das RV normalerweise eine Niederdruckperfusion des Lungengefäßsystems ermöglicht, ist es selbst bei mäßigem Anstieg des Lungenarteriendrucks (PAP) hochempfindlich. Ein RV-Versagen kann sich bei der Einstellung eines PH-Werts oder einer beeinträchtigten Kontraktilität entwickeln, die mit einem schnellen Fortschreiten der RV-Dilatation verbunden ist, was zu einem erhöhten enddiastolischen RV-Druck führt . Diese physiologischen Veränderungen können eine Verschiebung des interventrikulären Septums in Richtung einer bereits unterfüllten LV-Kammer verursachen und folglich eine Verringerung der LV-Vorlast und eine Abnahme der CO verursachen .
Risikofaktoren
Risikofaktoren für LoHF bleiben ein wenig erforschter Bereich. Wenig Daten aus klinischen Studien zu HF und von postoperativen LCOS-Patienten liefern jedoch wertvolle Einblicke in Risikofaktoren und Prädiktoren für LoHF. In der Analyse von 452 Patienten, die mit dekompensierter HF und niedrigem Herzzeitvolumen hospitalisiert waren, waren signifikante Risikofaktoren für LoHF Chagas-Krankheit (Relatives Risiko : 3,66), depressive Ejektionsfraktion (RR: 2,41), Hyponatriämie (RR: 1,62) und Nierenfunktionsstörung (RR: 1,92) . Risikofaktoren für eine postoperative LoHF sind eine beeinträchtigte LV-Funktion (< 50%), CABG an der Pumpe, Notfall- oder kardiopulmonaler Bypass (CPB) Operation, unvollständige Revaskularisation, Alter > 65 Jahre und ein kombiniertes Vorliegen von Diabetes mellitus und präoperativer Nierenfunktionsstörung . Zusätzlich zu den Patienten- und Operationsrisikofaktoren sind biochemische Prädiktoren für LoHF bei postoperativen Patienten niedrige Hämoglobinspiegel , Gesamtlymphozytenzahl < 2000 Zellen / µl und präoperative Spiegel von natriuretischen Serumpeptiden . In den letzten zwei Jahrzehnten haben sich die Trends bei einigen anerkannten Risikofaktoren geändert. Faktoren wie Bluthochdruck, weibliches Geschlecht, Dreifachgefäßerkrankung und linke Hauptkrankheit sind statistisch nicht mehr signifikant, während sich das mit einer depressiven präoperativen Ejektionsfraktion verbundene Risiko verdoppelt hat .
Diagnose
Es gibt keine Konsensrichtlinien oder nachgewiesenen diagnostischen Kriterien für LoHF-Patienten. Darüber hinaus sind klinische Anzeichen und Symptome unspezifisch. In Ermangelung standardisierter Richtlinien beruht die Diagnose in der Regel auf der Sammlung hämodynamischer und physiologischer Aberrationen, die für die Erhebung des klinischen Verdachts auf LoHF nützlich sind . Die Diagnose von LoHF allein reicht oft nicht aus. Die Ursache für den Low-Output-Zustand muss ebenfalls ermittelt werden. Bei einigen Ursachen für einen niedrigen Ausgangszustand wie PE oder MI ist die Behandlung der zugrunde liegenden Ursache die wichtigste Überlegung, und daher ist es unerlässlich, die Diagnose zu stellen. Da LoHF-Patienten oft instabil sind, ist es auch üblich, dass klinische Bewertung, Diagnose und Behandlung gleichzeitig auftreten, insbesondere in der Akutversorgung .
Anzeichen und Symptome
Ein niedriges Herzzeitvolumen als Hauptmerkmal einer akuten dekompensierten HF ist selten und betrifft nur 8,9 bis 9,6% der hospitalisierten HF-Patienten . LoHF kann viele klinische Merkmale mit CHF teilen, aber es gibt bemerkenswerte Unterschiede, die nachfolgende diagnostische Entscheidungen unterstützen oder leiten können. Übermäßige Müdigkeit und erhöhte Belastungsintoleranz sind wichtige erste Anzeichen, die LoHF-Patienten bereits vor der Diagnose bemerken . Darüber hinaus treten bei LoHF-Patienten häufig Unruhe, Verwirrtheit und / oder Bewusstseinsverlust, kalte / vasokonstriktive Peripherien oder verzögerte Kapillarfüllzeit, Hypotonie, Tachykardie oder Bradykardie, fadenförmiger Puls, erhöhter Jugularvenendruck, Atemnot und Hypoxämie sowie Oligurie / Anurie auf . Diese Anzeichen und Symptome können sich bei HF-Patienten zwischen geringer Perfusion und Stauung unterscheiden (Tabelle 2).
Tabelle 2. Symptome und Anzeichen einer niedrigen Perfusion vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Die ESC-Richtlinien 2016 zur Diagnose und Behandlung von HF betonen, wie wichtig es ist, eine detaillierte Anamnese und körperliche Untersuchung aller Patienten mit Verdacht auf HF zu erhalten . Die detaillierte Anamnese des Patienten oder von Verwandten und Freunden, wenn sich der Patient zu unwohl fühlt, sollte sich darauf konzentrieren, Informationen über Symptome, frühere und aktuelle kardiale und extrakardiale Zustände zu erhalten, die HF auslösen oder verschlimmern können, Exposition gegenüber Risikofaktoren für HF oder von Low-Output-Zustand und Medikamentenanamnese für frühere und aktuelle Erkrankungen . Zusätzlich zur Anamnese wird allen LoHF-Patienten eine körperliche Untersuchung empfohlen, um klinische Indikatoren für Hämodynamik, periphere Perfusion, Stauung, zugrunde liegende Ätiologie und Klappenpathologie zu ermitteln. Hämodynamische Parameter von Interesse sind Blutdruck, HR und Herzrhythmus, Galopprhythmus, Sauerstoffsättigung und Atemfrequenz . Tests für die periphere Perfusion sollten Bewusstseinsniveaus, periphere Haut / zentrale Temperatur, kapillare Nachfüllzeit und Urinausscheidung umfassen. Tests auf Stauung umfassen erhöhten Jugularvenendruck, periphere / pulmonale Ödeme, Hepatomegalie, Aszites und Pleuraergüsse. Tests für die zugrunde liegende Ätiologie sollten kardiovaskuläre Untersuchungen sowie Herzgeräusche und -geräusche umfassen. Schließlich sollte der Nachweis einer Klappenfunktionsstörung Perikarderguß und Nachweis eines Perikardergusses mit oder ohne Herztamponade umfassen .
Die Kombination von Anamnese und körperlicher Untersuchung hat sich bei der Beurteilung des hämodynamischen Status und der Erkennung von LoHF als von unschätzbarem Wert erwiesen . 1976 haben Forrester et al. körperliche Untersuchung von Patienten mit akutem Myokardinfarkt durchgeführt und vier hämodynamische Profile (A, B, L und C) identifiziert, wie in Abbildung 2 dargestellt. Hämodynamische Profile basieren auf dem Vorhandensein oder Fehlen einer Lungenstauung (Lungenkapillarkeildruck > oder ≤ 18 mmHg) und der Angemessenheit der Perfusion (CI > 2, 2 L/min/m2). Profil A stellt keine Staus / Hypoperfusion dar; Profil B Staus ohne Hypoperfusion; Profil C Hypoperfusion ohne Staus; und Profil L Staus und Hypoperfusion . LoHF-Patienten fallen unter die Profile L und C (Hypoperfusion ± ) basierend auf Nohria et al. nachweis, dass Profil L und C einen durchschnittlichen KI von 1,6 L/min/m2 bzw. 1,9 L/min/m2 aufweisen.
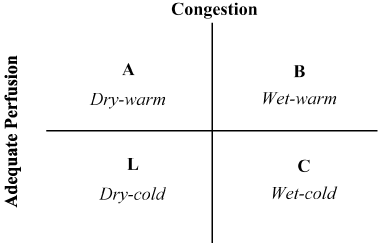
Abbildung 2. Schematische Darstellung des klinischen Profils der akuten dekompensierten Herzinsuffizienz
Die Stauung wird anhand von Orthopnoe, Jugularvenendistension, Lungengeräuschen, hepatojugulärem Reflux, Aszites, peripherem Ödem, abdominalem Reflux und Valsalva-Rechteckwelle beurteilt. Eine niedrige Perfusion wurde durch das Vorhandensein eines engen Pulsdrucks, Pulsusveränderungen, kalte Extremitäten, möglicherweise Schläfrigkeit, sinkende Serumnatriumspiegel und Verschlechterung der Nierenfunktion beurteilt. Angepasst von Nohria, et al.
Elektrokardiogramm (EKG): Sowohl die AHA- als auch die ESC-Richtlinien für HF empfehlen, bei allen Patienten mit Verdacht auf HF so früh wie möglich ein Elektrokardiogramm (EKG) durchzuführen. Das EKG kann eine Vielzahl von Anomalien aufweisen und ist bei HF-Patienten sehr unwahrscheinlich normal. Es kann auch Hinweise auf eine zugrunde liegende Ätiologie der Herzfunktionsstörung geben, einschließlich Bradykardie, atrioventrikulärer Block, Sinustachykardie, atrialer oder ventrikulärer Tachyarrhythmie, Ischämie, LV-Hypertrophie und Niederspannungskomplexe .
Grundlegende Labortests: Die AHA- und ESC-HF-Richtlinien empfehlen auch grundlegende Labortests in der klinischen Erstbewertung, um die Diagnose von HF oder die Ursache des niedrigen Ausgangszustands zu unterstützen. Blutuntersuchungen sollten bei allen vermuteten HF-Patienten durchgeführt werden. Hämoglobin (Hb > 10 g / dl) zeigt eine optimale Sauerstoffversorgung des Gewebes an), chronische Anämie ist bei chronischer HF häufig und deutlich erhöhte weiße Blutkörperchen erhöhen den Verdacht auf eine alternative Diagnose. Tests auf Serumelektrolyt zur Bestimmung des Kalium-, Magnesium- und Calciumspiegels. Harnstoff- und Kreatinin-Tests zur Beurteilung der bei HF häufigen Nierenhypoperfusion und -dysfunktion. Tests auf Leberfunktionsstörungen, die auf eine beeinträchtigte RV und / oder Leberverstopfung hindeuten. Glukosetest zur Beurteilung einer Hypoglykämie, die die Herzfunktion beeinträchtigen kann. Schilddrüsenfunktionstests auf Hypo- oder Hyperthyreose, die einen intrinsischen Myokardinfarkt verursachen können. Schließlich Tests auf natriuretische Peptide im Serum, deren erhöhte Spiegel auf eine erhöhte ventrikuläre Wandspannung hinweisen, die jedoch aufgrund ihrer langen Halbwertszeit keine abrupten Änderungen des ventrikulären Fülldrucks erkennen .
Kardiale Bildgebungstests: Die kardiale Bildgebung spielt eine zentrale Rolle bei der Diagnose von HF sowie bei der Überwachung und Steuerung der Therapie. Echokardiographie ist die bevorzugte Modalität aus Gründen der Genauigkeit, Verfügbarkeit, Sicherheit und Wirtschaftlichkeit . Es kann durch andere Bildgebungsmodalitäten ergänzt werden, die auf der Grundlage der Fähigkeit ausgewählt werden, spezifische klinische Fragen unter Berücksichtigung von Kontraindikationen und Risiken zu beantworten .
Echokardiographie: Die Echokardiographie wird dringend für alle Verdachtspatienten empfohlen, da sie die klinische Diagnose von LoHF bestätigen oder ausschließen, SV und seine Variationen beurteilen und die Ursache für den Zustand mit geringer Leistung bestimmen kann . Die transthorakale Echokardiographie sollte so bald wie möglich nach der klinischen Diagnose eines niedrigen Herzzeitvolumens durchgeführt werden. Es misst nicht nur das Ausmaß der systolischen und diastolischen Dysfunktion, sondern liefert auch wertvolle Informationen über ventrikuläre Morphologie, Klappenfunktionsstörungen, Myokard- und Perikarderkrankungen sowie regionale Wandbewegungsstörungen . Die Echokardiographie bewertet die systolische Funktion durch Messung des LEVF, wobei > 45-50% als normal angesehen werden. Auf der anderen Seite wird die diastolische Funktion unter Verwendung von Mitralblutflussmustern, Lungenvenenfluss und Gewebedoppler am Mitralanulus bewertet, während CO und SV unter Verwendung des Dopplerprinzips bewertet werden. Der Pulmonalarteriendruck (PAP) kann durch Messen der Regurgitatstrahlgeschwindigkeit geschätzt werden. Hoher PAP in Gegenwart von dilatativem RV mit septaler Abflachung oder Verbeugung in den LV, was auf einen akuten Anstieg des RV-Drucks hinweist, der den klinischen Verdacht auf PE als Ursache für einen niedrigen Ausgangszustand erhöht .
Röntgenaufnahme des Brustkorbs: Bei Patienten mit Verdacht auf LoHF könnte eine Röntgenaufnahme des Brustkorbs in Betracht gezogen werden. Wichtige Indikatoren, die für die Beurteilung berücksichtigt werden sollten, sind ein vergrößertes Herz, das auf Kardiomegalie oder LV-Hypertrophie hinweist; pulmonale venöse Stauung, die auf einen erhöhten LV-Fülldruck hinweist; und Pleuraerguss, der auf erhöhten LV-Druck, Lungenembolie oder Postherzchirurgie hinweist( .
Koronarangiographie: Die Indikationen für die Koronarangiographie bei LoHF-Patienten sollten mit den Empfehlungen der einschlägigen Konsensrichtlinien für HF übereinstimmen . Bei HF-Patienten mit Brustschmerzen und Anzeichen eines ST-Hebungs-Myokardinfarkts (STEMI) im EKG sollte die Revaskularisation unter Verwendung einer primären perkutanen Koronarintervention so bald wie möglich durchgeführt werden. Die Koronarangiographie sollte auch bei Patienten mit ischämischer Ätiologie nach Herzstillstand in Betracht gezogen werden, wenn Hinweise auf HF vorliegen, und bei Patienten, die sich von einem Zustand mit niedrigem Output erholt haben, wenn die Ursache nicht ermittelt wurde .
Klinisches Management
Das Vorhandensein von LoHF stellt einen Zustand mit sehr hohem Risiko dar, der eine sofortige Behandlung erfordert, jedoch keine standardisierten Richtlinien für das klinische Management enthält . Folglich berücksichtigen Kliniker normalerweise die individuelle Pathophysiologie, um die am besten geeignete Behandlungsstrategie auszuwählen . Bei akuten LoHF-Patienten empfehlen die ESC HF-Richtlinien 2016 die Verwendung von hämodynamischen Profilen (basierend auf dem Vorhandensein oder Fehlen einer Stauung und der Angemessenheit der Perfusion), um das klinische Management zu leiten . Für LoHF-Patienten im Profil L (keine Stauung, aber hypoperfundiert) und Profil C (sowohl Stauung als auch hypoperfundiert), die sich im akuten Dekompensationszustand befinden, können Notfallbehandlungsziele die Wiederbelebung von Patienten, die Wiederherstellung der Sauerstoffversorgung, die Verbesserung der Organperfusion und die Optimierung der Hämodynamik (Schlagvolumen und CO) sowie die Lösung von Symptomen umfassen. Andere nachfolgende Ziele umfassen eine optimale Überwachung und Ermittlung der zugrunde liegenden Ursache für ein niedriges Herzzeitvolumen und die Behandlung der Ursache, falls reversibel . Derzeit verfügbare therapeutische Ziele für LoHF sind die Optimierung der Sauerstoffversorgung des Gewebes, die Stabilisierung der Durchblutung und die Behandlung reversibler Ursachen für einen niedrigen Ausgangszustand (Abbildung 3).
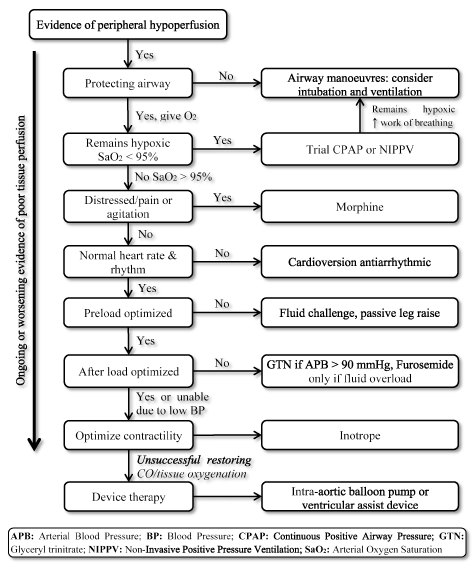
Abbildung 3. Behandlungsalgorithmus für Low-Output-Herzinsuffizienz
Die Behandlung von LoHF zielt darauf ab, die Sauerstoffversorgung des Gewebes zu verbessern und die Durchblutung zu stabilisieren, basierend auf anhaltenden oder sich verschlechternden Symptomen der Gewebeperfusion. Die Behandlung beginnt mit der Verbesserung der Beatmung durch Abgabe von Sauerstoff mit hohem Durchfluss, kontinuierlichem positivem Atemwegsdruck (CPAP) oder nicht-invasiver Überdruckbeatmung (NIPPV). Wenn dies nicht gelingt, werden Kardioversion oder Antiarrhythmika verabreicht, um die Herzfrequenz zu normalisieren, Flüssigkeitsretention zur Optimierung der Vorlast und / oder Vasodilatatoren und Inotrope zur Manipulation bzw. Wenn die vorherige Beatmung und Medikation bei der Wiederherstellung des Herzzeitvolumens und / oder der Sauerstoffversorgung des Gewebes nicht erfolgreich waren, kann eine Gerätetherapie mit einer intraaortalen Ballonpumpe oder ventrikulären Hilfsgeräten in Betracht gezogen werden
Optimierung der Sauerstoffversorgung des Gewebes (Beatmungsstrategien)
Das klinische Management von LoHF-Patienten beginnt häufig mit der Beurteilung von Atemwegen, Atmung und Kreislauf auf Anzeichen einer peripheren Hypoperfusion. Beatmungsstrategien wie oropharyngeale oder nasopharyngeale Atemwege sind häufige Hilfsmittel zur Wiederherstellung oder Aufrechterhaltung der Durchgängigkeit der Atemwege bei LoHF-Patienten mit vermindertem Bewusstsein aufgrund verminderter zerebraler Perfusion. Eine zusätzliche endotracheale Intubation sollte in Betracht gezogen werden, wenn der Patient mit beeinträchtigten Atemwegen verbleibt . Wenn die Patienten weiterhin hypoxisch bleiben (SaO2 < 95%), kann eine Maximierung der Sauerstoffzufuhr unter Verwendung von Sauerstoff mit hohem Durchfluss, kontinuierlichem positivem Atemwegsdruck (CPAP) oder nicht-invasiver Überdruckbeatmung (NIPPV) in Betracht gezogen werden. Bei Patienten ohne Besserung kann eine Intubation oder Beatmung in Betracht gezogen werden .
Durchblutung stabilisieren
Das Herzzeitvolumen (CO) ist eine Funktion von HR und SV. SV wiederum hängt von vier Zirkulationsvariablen ab – Herzfrequenz, Vorlast, Kontraktilität und Nachlast. Die Optimierung all dieser Variablen verbessert die CO bei LoHF-Patienten . Im klinischen Umfeld hängen Strategien zur Erhöhung der CO von der zugrunde liegenden Ursache und der betroffenen Zirkulationsvariablen ab . Klinische Interventionen umfassen Volumenanpassung, pharmakologische Unterstützung und Gerätetherapie.
Herzfrequenz/Rhythmus: Als Teil der physiologischen Reaktion des Körpers erhöht die Erhöhung der HR die CO. Zu schnelle oder langsame HR wirkt sich nachteilig auf CO aus. Bei LoHF-Patienten mit Tachykardie (zu schnelle Ruhe-HR > 100 bpm), die verzweifelt, unruhig und dyspnoisch sind, kann Morphin verabreicht werden, um Dyspnoe, Schmerzen und Unruhe zu lindern sowie Es ist ein milder Venodilatator zur Verringerung der Nachlast, insbesondere bei CPAP- oder NIPPV-Patienten . Wenn HR < 40 bpm mit Anzeichen eines hämodynamischen Kompromisses und / oder einer beeinträchtigten CO, Medikamente, die HR erhöhen (Atropin und Anticholinergika ) oder Interventionen wie transkutane / transvenöse Stimulation sollten durchgeführt werden. Bei ausgewählten LoHF mit ventrikulärer / supraventrikulärer Tachykardie oder schnellem Vorhofflimmern mit Anzeichen eines kardiovaskulären Kompromisses sollte eine dringende elektrische Kardioversion in Betracht gezogen werden .
Vorspannung optimieren (Volumenanpassungen): Die Messung der Vorspannung ist für die Optimierung unerlässlich. Es wird bei Patienten mit klinischem Nachweis einer beeinträchtigten peripheren Perfusion empfohlen. Eine Fluid-Challenge sollte durchgeführt werden, um die Reaktionsfähigkeit der Vorspannung zu bewerten. Schnelles Infundieren von 250 ml Flüssigkeit (kristalloid oder Kolloid) für mehr als fünf Minuten und objektive Beurteilung der Wirkung auf SV. Wenn der Effekt eine Zunahme oder Abnahme > 10% ist, sollte der Patient weiterhin Flüssigkeitsbolus erhalten, um die Vorlast zu optimieren, bis er nicht mehr auf Flüssigkeit anspricht . Bei Patienten mit Anzeichen einer Stauung und eines Lungenödems, die keinen Flüssigkeitsbolus benötigen, kann eine passive Beinerhöhung durchgeführt werden, bei der das Bein des Patienten auf 45 Grad angehoben wird, um die Notwendigkeit eines Flüssigkeitsbolus auszuschließen. Wenn die Antwort günstig ist, kann eine echte Flüssigkeitsherausforderung gegeben werden .Nachlast (Pharmakologische Unterstützung): Nachlast ist der Widerstand, gegen den der Ventrikel Blut ausstößt, manchmal geschätzt als SVR. Die Nachlast sollte bei LoHF-Patienten mit hoher Nachlast, niedrigem CO, Anzeichen einer schlechten peripheren Perfusion und Lungenödem reduziert werden. LoHF-Patienten mit systolischem BLUTDRUCK ≥110 mmHg sollten eine pharmakologische Unterstützung mit Vasodilatatoren erhalten. Bei Patienten mit systolischem Blutdruck < 90 mmHg und mittlerem arteriellen Druck < 65 mmHg werden Vasodilatatoren wegen des Risikos einer Hypotonie, die die Organperfusion erschweren kann, nicht empfohlen. Bei diesen Patienten wird Inotropes als erste Behandlungslinie empfohlen .
Verbesserung der Kontraktilität (Pharmakologische Unterstützung): Wenn der Patient trotz Eingriffen in Bezug auf Herzfrequenz, Vor- und Nachlast weiterhin Anzeichen einer Gewebehypoperfusion oder einer verminderten Sauerstoffzufuhr aufweist, sollte eine Behandlung zur Verbesserung der Kontraktilität in Betracht gezogen werden. In der Zwischenzeit sollte die Optimierung der Sauerstoffzufuhr fortgesetzt werden, um Hämoglobin ≥10 g / dl anzustreben und eine optimale Sauerstoffsättigung (SaO2) sicherzustellen. Faktoren, die die Kontraktilität des Myokards beeinträchtigen, sind Hyperkaliämie, Hypomagnesiämie, Hypokalzämie, schwere Azidose, Hypoxie und Hypoglykämie, die korrigiert werden müssen. Inotrope werden empfohlen, um die Kontraktilität und anschließend die CO bei LoHF-Patienten mit niedrigem Blutdruck und / oder niedrigem KI bei Anzeichen einer schlechten peripheren Perfusion oder Stauung zu verbessern . Pharmakologische Unterstützung mit Dobutamin (ein Inotrop) sollte jedoch bei Patienten mit Tachykardie oder AF mit Vorsicht angewendet werden, da dies die AV-Knotenleitung erhöht und schnelle ventrikuläre Rhythmen auslösen kann . Andererseits wird Levosimendan bei LoHF-Patienten mit akuter Myokardischämie oder nach einer Herzoperation empfohlen, da es den myokardialen Sauerstoffbedarf nicht erhöht . Langfristige Wirkung von inotropen könnte schädlich sein und daher sollte ihre Verwendung gestoppt werden, sobald Stabilität erreicht wurde. Vasopressoren sollten nicht das First-Line-Medikament in Low-Output-Zuständen sein, da sie die SVR erhöhen und anschließend die CO beeinträchtigen. Eine duale Therapie von Vasopressoren und Inotrop wird jedoch bei Patienten mit Sepsis als Ursache für einen niedrigen Ausgangszustand empfohlen .Gerätetherapie: Eine Gerätetherapie sollte bei LoHF-Patienten in Betracht gezogen werden, wenn optimale medizinische Therapien bei der Wiederherstellung der CO- und Gewebeoxygenierung nicht erfolgreich waren. Gängige Gerätetherapien umfassen die intraaortale Ballonpumpe (IABP) und das ventrikuläre Hilfsgerät (VAD). Die Anwendung von IABP ist bei LoHF-Patienten mit ischämischer Herzkrankheit, prä- oder postperkutaner Intervention oder Postherzchirurgie häufig. IABP besteht aus einem Ballon, der durch die Oberschenkelarterie in die Aorta eingeführt wird. Der Ballon bläst sich während der Diastole auf und entleert sich während der Systole, um den diastolischen Blutdruck und folglich die Koronarperfusion zu erhöhen, und verringert die Nachlast, wodurch die CO erhöht wird. Auf der anderen Seite ist die Verwendung von VAD ungewöhnlich. Es kann nur in Fachzentren verwendet werden. Es wird häufig als Brücke zur Herztransplantation bei Patienten mit günstiger Lebensqualität oder zur Genesung bei Patienten mit akuter Myokarditis eingesetzt .
Behandlung der zugrunde liegenden Ursachen
Einige Ursachen für einen niedrigen Ausgangszustand bei Patienten mit LoHF können mit spezifischen Therapien rückgängig gemacht werden. Reversible Ursachen sollten frühzeitig während der ersten klinischen Bewertung identifiziert werden. Diese Ursachen umfassen akuten Myokardinfarkt, Herztamponade, Spannungspneumothorax, Lungenembolie und akutes Klappenversagen . (Tabelle 3).
Metaanalyse der Diagnose und des klinischen Managements
Die Grundlage der klinischen Diagnose von LoHF war der echokardiographische Nachweis einer systolischen LV / RV-Dysfunktion und / oder einer diastolischen LV-Dysfunktion, begleitet von Anzeichen einer Verringerung von CO und SvO2 . Hämodynamische Profile basierend auf Kongestions- und Perfusionsmaßen wurden verwendet, um akute HF-Patienten in vier Profile zu klassifizieren: trocken-warm (A), nass-warm (B), trocken-kalt (L) und nass-kalt (C) und nützlich bei der Identifizierung von LoHF-Patienten . LoHF-Patienten wurden in Profile (L) und (C) eingeteilt, basierend auf dem Vorhandensein / Fehlen einer Stauung und / oder der Unzulänglichkeit der peripheren Perfusion . Diese beiden hämodynamischen Profile bilden die Grundlage für die Auswahl von Patienten mit LoHF in klinischen Studien und bieten eine einfache Beurteilung am Krankenbett, um Patienten zum Zeitpunkt der Präsentation zu klassifizieren und die Auswahl der ersten Therapien zu leiten . Das Ziel der vorliegenden Metaanalyse ist es, veröffentlichte Beweise für gemeinsame diagnostische Merkmale und Behandlungsergebnisse für Patienten mit LoHF zu aggregieren.
Suchstrategie
Drei große Online-Datenbanken (PubMed, EMBASE und Cochrane) wurden seit der Einführung bis Dezember 2018 systematisch nach Studien durchsucht, die die Diagnose und das klinische Management von LoHF untersuchen. Um zu vermeiden, dass Studien übersehen werden, in denen LoHF nicht im Titel oder Abstract erwähnt wurde, wurden die ersten 200 Artikel mit Relevanzrang aufgenommen, die mit einer Volltext-Google Scholar-Suche abgerufen wurden. Es wurden keine zeitlichen oder sprachlichen Einschränkungen für die Veröffentlichung angewendet. Zusätzliche Studien wurden durch eine manuelle Suche in der Referenzliste aus den eingeschlossenen Studien sowie aus relevanten Übersichtsartikeln identifiziert, die dann den Einschlusskriterien unterzogen wurden. Die Suchkriterien umfassten Population von Interesse (Patienten mit LoHF oder LCOS), diagnostische Tests von Interesse (Echokardiographie und hämodynamische Profile) und Intervention von Interesse (Beatmungsstrategien, Volumenanpassung, pharmakologische Unterstützung und Gerätetherapie). Studien wurden eingeschlossen, wenn sie die folgenden Kriterien erfüllten: (a) eingeschlossene Patienten mit LoHF; (b) mit Echokardiographie und hämodynamischen Profilen diagnostiziert; (c) behandelte Patienten zur hämodynamischen Stabilisierung; und (d) berichtete Behandlungsergebnisse. In Fällen von Studien, in denen doppelte Daten gemeldet wurden, wurde nur die Studie eingeschlossen, die die größte Anzahl von Patienten lieferte. Konferenz-Abstracts, Fallberichte und Übersichtsartikel wurden ausgeschlossen.
Studienauswahl
Abbildung 4 veranschaulicht den Such- und Screening-Prozess, der verwendet wird, um geeignete Studien einzuschließen. Zwei Gutachter überprüften unabhängig voneinander alle Titel und Abstracts, die aus der systematischen Online-Suche abgerufen wurden. Abstracts, die Population, Intervention und Ergebnisse von Interesse enthielten, wurden für die Volltextsuche aufgenommen. Anschließend prüften die beiden Gutachterinnen und Gutachter auch unabhängig voneinander Volltextartikel anhand der Einschlusskriterien. In Fällen von Diskrepanzen wurde es durch Diskussion und Konsens gelöst.

Abbildung 4. Flussdiagramm des Literaturrecherche- und Einschlussprozesses
Datenerfassung
Zwei Gutachter extrahierten unabhängig voneinander Daten aus den eingeschlossenen Studien und jede Diskrepanz wurde durch Konsens gelöst. Die wichtigsten extrahierten Daten waren echokardiographische und hämodynamische Profildaten sowie die verwendete Behandlung und das Behandlungsergebnis zur Hämodynamik (Herzindex, PCWP) und Mortalität. Zusätzlich zu diesen Hauptdaten extrahierten die beiden Gutachter auch Daten zu Studienmerkmalen, Patientenmerkmalen und Nachbeobachtungsdauer (Tabelle 4).
Statistische Analyse
Interessante Ergebnisse, die in mehr als einer Studie berichtet wurden, sind Herzindex, PCWP und Mortalität. Für jedes Ergebnis wurden zusammenfassende Statistiken (Mittelwert ± Standardabweichung) vor und nach der Intervention extrahiert oder der Unterschied zwischen Baseline und nach der Behandlung. Diese zusammenfassenden Statistiken wurden getrennt für die Behandlungs- und Kontroll- / Placebogruppen extrahiert. Diagnoseergebnisse und Behandlungseffekte wurden durch Mittelwertunterschiede vor und nach der Intervention und dem damit verbundenen 95% -Konfidenzintervall gemessen. Waldparzellen wurden verwendet, um die Heterogenität (I2) über Studien hinweg visuell zu untersuchen. Der gepoolte Diagnose- und Behandlungseffekt und das damit verbundene 95% -Konfidenzintervall wurden unter Verwendung eines festen Effekts (I2 < 49%) oder eines Zufallseffektmodells (I2 > 50%) geschätzt. Der P-Wert > 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Studienmerkmale
Zwölf (12) randomisierte kontrollierte Studien (RCTs) erfüllten die Einschlusskriterien. In sieben (7) Studien wurden LoHF-Patienten und in den verbleibenden fünf (5) HF-Patienten eingeschlossen, die sich einer Herzoperation mit niedrigem Herzzeitvolumen unterzogen haben. Die Mehrheit der veröffentlichten klinischen Studien (10) untersuchte Medikamente, die die Wirkung verschiedener Arten von Inotropen auf die Hämodynamik und die Prävention des Todes verglichen: nur Dobutamin , Dobutamin und Dopamin ; Levosimendan und Dobutamin sowie Levosimendan und Placebo . Von den verbleibenden zwei klinischen Studien untersuchte jede Vasodilatator (Nitroprussid) und Placebo sowie Gerätetherapie (IABP) und Inotrop (Levosimendan) allein oder in Kombination mit IAPB . Insgesamt nahmen an den 12 klinischen Studien 3.738 Patienten im mittleren Alter von 64 Jahren (Bereich = 55-74 Jahre) teil, wobei die Mehrheit männlich war (78%).
Synthese der Ergebnisse
Die Diagnosedaten zu LoHF waren inkonsistent. In den zwölf klinischen Studien ergab sich keine gemeinsame Definition von LoHF, die für die Diagnose hilfreich gewesen wäre. Zu den hämodynamischen Kriterien für die Aufnahme von Patienten in die Studien gehörten CI < 2,0 L/min/m2 , CI < 2,2 L/min/m2 oder CI < 2,5 L/min/m2 und PCWP > 15 mmHg oder ≥18 mmHg . Die Definition variierte auch zwischen den Studien – postoperativer Zustand mit Hypotonie (systolischer Blutdruck < 90 mmHg für > 30 Minuten) oder die Notwendigkeit einer inotropen Unterstützung zur Aufrechterhaltung des systolischen Blutdrucks > 90 mmHg und Endorganhypoperfusion (kalte Peripherien, Urinausstoß < 30 ml/Stunde) . Der kardiogene Schock wurde als komplexes Syndrom beschrieben, das eine Kaskade akuter LV-Dysfunktion, verminderter CO, Hypotonie und Gewebehypoperfusion beinhaltet .
Die Abbildungen 5 und 6 zeigen Forest-Plots für den standardisierten Mittelwert des Herzindex zu Studienbeginn bzw. nach inotroper oder vasodilatatorischer Therapie. Der Ausgangswert des Herzindex stieg von einem Mittelwert von 1,93 (95%-KI: 1,91-1,95) auf einen Mittelwert nach der Behandlung von 2,82 (95% -KI: 2,80-2,84). Abbildung 7 zeigt ein Forest-Diagramm für die mittlere Standarddifferenz (SMD) des Herzindex nach Behandlung mit Levosimendan und Dobutamin. Levosimendan erreichen höhere Herzindex im Vergleich zu Dobutamin (SMD: 2,82; 95% CI: 2,54-3,10). Als Prophylaxe gegen LoHF bei postoperativen Patienten erreichte die Levosimendan-Infusion nach Narkose einen höheren Herzindex (2,57) im Vergleich zu präoperativem IABP (2,3) oder mit einer Kombination von Levosimendan (2,4). Abbildung 8 zeigt ein Walddiagramm der Sterblichkeitsrate zwischen Levosimendan und Placebo. Levosimendan hatte im Vergleich zu Placebo eine niedrigere Mortalitätsrate (Odds Ratio : 0, 83; 95% -KI: 0, 59-1, 18), aber der Unterschied war statistisch nicht signifikant (p = 0, 30). Abbildung 9 zeigt ferner, dass Levosimendan im Vergleich zu Dobutamin eine niedrigere Mortalitätsrate aufweist (OR: 0,65; 95% -KI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
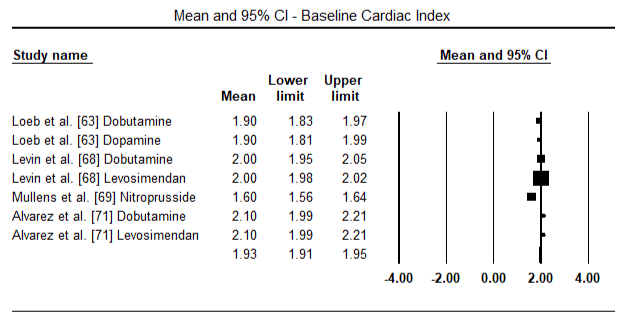
Figure 5. Mean baseline cardiac index
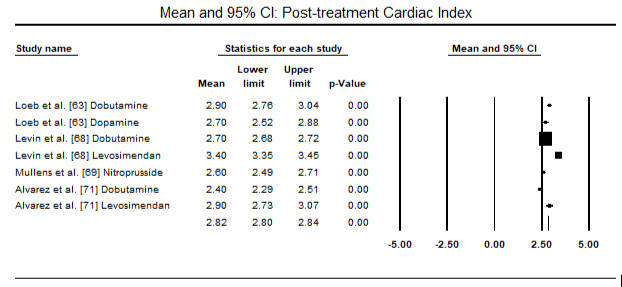
Figure 6. Mean post-treatment cardiac index
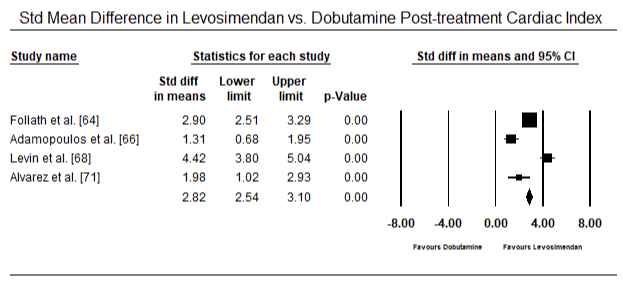
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
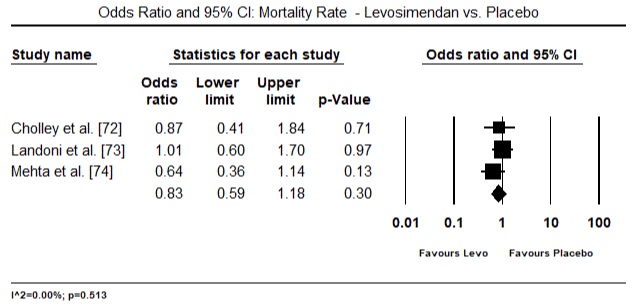
Figure 8. Mortality rate between levosimendan and placebo
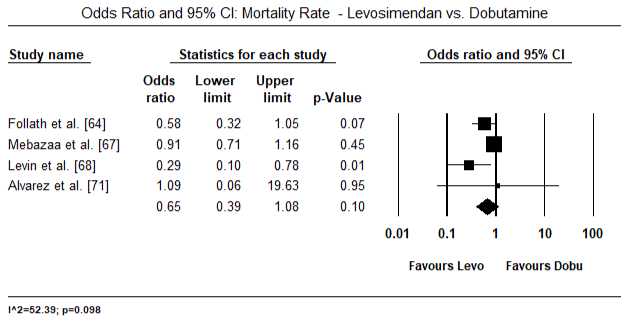
Figure 9. Mortalitätsrate zwischen Levosimendan und Dobutamin
Diskussion der Ergebnisse
Diese systematische Überprüfung und Metaanalyse bewertete gemeinsame diagnostische Merkmale und Behandlungsergebnisse der Medizin- und Gerätetherapie (IABP) bei LoHF-Patienten. Die Ergebnisse deuten darauf hin, dass LoHF-Patienten keine allgemein akzeptierten oder standardisierten Diagnosemerkmale aufweisen. Obwohl LoHF-Patienten mehrere Merkmale aufweisen könnten, einschließlich Herzindex, PCWP, systolischer Blutdruck und SvO2, um eine klinische Diagnose vorzuschlagen oder zu unterstützen, weisen alle diese Merkmale unterschiedliche Grenzwerte auf Studien. Der Herzindex, der das häufigste klinische Merkmal für einen niedrigen Ausgangszustand bei LoHF ist, hat drei Grenzwerte: < 2,0 L/ min/m2 , < 2,2 L/min/m2 oder < 2,5 L/min/m2 . Die inotrope Unterstützung erwies sich als sehr häufige Intervention zur Verbesserung der Perfusion und Normalisierung des Herzzeitvolumens bei LoHF-Patienten.
Inotrope Medikamente wie Levosimendan, Dobutamin, Dopamin, Vasodilatator (Nitroprussid) und IABP verbesserten das KI zwischen Baseline und Post-Treatment signifikant. In Bezug auf Inotrope ist Levosimendan wirksamer bei der Verbesserung der hämodynamischen Stabilität und eine bessere Prophylaxe gegen den kurzfristigen Tod (30-Tage-Mortalität) als Dobutamin. Darüber hinaus können Inotrope als Prophylaxe gegen die Entwicklung von postoperativem LoHF wirken. Andererseits verbessern Inotrope zwar die Hämodynamik und normalisieren das Herzzeitvolumen, bieten jedoch unabhängig von der Art des verwendeten Inotrops keinen signifikant besseren Schutz vor Mortalität.
Die Rolle von Inotropen bei der Behandlung von LoHF wurde durch eine frühere Überprüfung von Inotropika und Vasodilatatorstrategien zur Behandlung von kardiogenem Schock und LCOS unterstützt . Die Überprüfung berichtete, dass Inotrope die Hämodynamik verbessern, unerwünschte Ereignisse bei postoperativen LCOS und reduzierte Mortalität. Neuere Inotrope wie Levosimendan (ein Calciumsensibilisator und Inodilatator) ist ein positives Inotrop hat einige vasodilatatorische Eigenschaften . Es kann auch als selektiver Lebervasodilatator angesehen werden, der den Pfortaderfluss über die Leberarterie und den Pfortaderfluss verbessern kann, verglichen mit Dobutamin, das nur den Pfortaderfluss verbessern kann, ohne die Leberarterie zu vasodilatieren . Levosimendan erhöht auch nicht den myokardialen Sauerstoffbedarf und wird bei LoHF-Patienten mit akuter Myokardischämie oder nach einer Herzoperation gegenüber Dobutamin empfohlen . Bei postoperativer LoHF bleibt die Schutzwirkung von Inotropen gegen die Kurzzeitmortalität (30-Tage-Mortalität) im Vergleich zu Placebo unbedeutend .
Die vorliegende systematische Überprüfung und Metaanalyse weist einige wichtige Einschränkungen auf. LoHF kann sekundär zu einer zugrunde liegenden Herzerkrankung wie akutem Myokardinfarkt oder postoperativ auftreten. Die meisten der eingeschlossenen Studien untersuchten postoperative LoHF mit weniger Darstellung von LoHF aus anderen Ursachen. Die meisten Studien konzentrierten sich auf zwei Inotrope (Levosimendan und Dobutamin), was das Verständnis anderer Inotrope sowie anderer Therapien wie Gerätetherapien einschränkte. In einigen Studien bestand das Risiko einer Fehlklassifizierung aufgrund einer signifikanten Anzahl von Patienten, die bei der Nachsorge verloren gingen. Da die meisten Studien keine paarweisen Prä- und Post-Interventionsunterschiede mit assoziierter Standardabweichung, Prä- und Post-Interventionsunterschiede mit Standardabweichung, Prä- und Post-Interventions-Ergebnismaße als unabhängig melden, erhält dies sider Konfidenzintervalle für den Behandlungseffekt mit einer assoziierten Standardabweichung.
Schlussfolgerung
Low-Output-Herzinsuffizienz (LoHF) ist ein klinisches Syndrom, das durch ein vermindertes Herzzeitvolumen gekennzeichnet ist, das von einer Endorganhypoperfusion begleitet wird. Es ist eine seltene Form der Herzinsuffizienz in der Allgemeinbevölkerung, aber weit verbreitet bei HF-Patienten nach der Operation. Seine Ätiologie ist heterogen und besteht aus verschiedenen Zuständen, die einen niedrigen Ausgangszustand und eine Herzoperation verursachen. Die wichtigsten pathophysiologischen Mechanismen sind die systolische und / oder diastolische LV-Dysfunktion und die RV-Dysfunktion, die durch Änderungen der Herzfrequenz, der Vorlast, der Nachlast und / oder der Kontraktilität verursacht werden. Zu den allgemeinen Risikofaktoren für LoHF gehören die Chagas-Krankheit, eine depressive Ejektionsfraktion und Nierenfunktionsstörungen, während bei postoperativen Patienten eine beeinträchtigte LV-Funktion, eine unvollständige Revaskularisation, ein höheres Alter und das Vorhandensein von Diabetes und Nierenfunktionsstörungen auftreten. Diagnose fehlt standardisierte Richtlinien und abhängig von akzeptierten Sammlung von hämodynamischen und physiologischen Aberrationen, einschließlich Bedingungen, die Low-Output-Zustand verursachen. Anamnese und körperliche Untersuchung helfen bei der Beurteilung des hämodynamischen Status und erkennen den Zustand mit niedrigem Output, während die Echokardiographie die ventrikuläre Dysfunktion (HF) und das niedrige Herzzeitvolumen bestätigt. Andere Tests zur Unterstützung der Diagnose oder zur Feststellung der Ursache eines Zustands mit geringer Leistung umfassen Elektrokardiogramm- und grundlegende Labortests (Blut, Serumelektrolyt, Harnstoff und Kreatinin, Lebertest, Schilddrüsenfunktion und natriuretische Serumpeptide) und Herzbildgebung (Thoraxröntgen oder Koronarangiographie). Die Behandlung hat keine etablierten Richtlinien, hängt jedoch von der Beurteilung der individuellen Pathophysiologie ab, um die am besten geeignete Behandlungsstrategie auszuwählen. Die Behandlung umfasst Beatmungsstrategien zur Verbesserung von Herzfrequenz und Rhythmus; Volumenanpassung zur Optimierung der Vorlast; pharmakologische Unterstützung (Inotrope und Vasodilatatoren) zur Manipulation der Nachlast und Verbesserung der Kontraktilität; und Gerätetherapie (intraaortale Ballonpumpe oder ventrikuläre Hilfsvorrichtung), wenn diese Strategien das Herzzeitvolumen nicht wiederherstellen. Bei ausgewählten Patienten können Therapien zur Umkehrung der Grunderkrankung das Herzzeitvolumen wiederherstellen.
- Inamdar A, Inamdar A (2016) Diagnose, Management und Nutzung von Herzinsuffizienz. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) Jüngste Entwicklungen bei Herzinsuffizienz. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Leitlinien für die Diagnose und Behandlung von akuter und chronischer Herzinsuffizienz 2012: Die Task Force für die Diagnose und Behandlung von akuter und chronischer Herzinsuffizienz 2012 der Europäischen Gesellschaft für Kardiologie. Entwickelt in Zusammenarbeit mit der Heart Failure Association (HFA) des ESC. Eur J Herz versagt 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, et al. (2013) 2013 ACCF / AHA-Richtlinie für das Management von Herzinsuffizienz: ein Bericht der American College of Cardiology Foundation / American Heart Association Task Force für Praxisrichtlinien. J Am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 ESC-Leitlinien für die Diagnose und Behandlung von akuter und chronischer Herzinsuffizienz: Die Task Force zur Diagnose und Behandlung von akuter und chronischer Herzinsuffizienz der Europäischen Gesellschaft für Kardiologie (ESC) wurde mit dem besonderen Beitrag der Heart Failure Association (HFA) der ESC entwickelt. Eur Herz J 37: 2129-2200.Masse L, Antonacci M (2005) Syndrom mit niedrigem Herzzeitvolumen: Identifizierung und Management. Crit Pflege Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) Kongestive Herzinsuffizienz. Am J Respir Kritische Pflege Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Zusammenfassung der Leitlinien zur Diagnose und Behandlung akuter Herzinsuffizienz: Die Task Force für akute Herzinsuffizienz der Europäischen Gesellschaft für Kardiologie. Eurasien J 26: 384-416.Parr GV, Blackstone EH, Kirklin JW (1975) Herzleistung und Mortalität früh nach intrakardialer Operation bei Säuglingen und Kleinkindern. Auflage 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) Postoperativer Verlauf und hämodynamisches Profil nach der arteriellen Schalteroperation bei Neugeborenen und Säuglingen: ein Vergleich von Low-Flow-kardiopulmonalen Bypass und Kreislaufstillstand. Auflage 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) Kardiale und neurologische Komplikationen identifizieren Mortalitätsrisiken für Männer und Frauen, die sich einer Bypass-Operation der Koronararterien unterziehen. Anästhesiologie 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) Predictors of low cardiac output syndrome after coronary artery bypass. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) Epidemiologie und neue Prädiktoren für ein Syndrom mit niedrigem Herzzeitvolumen nach isolierter Bypass-Transplantation der Koronararterien. Eurasien J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, et al. (2012) Risikofaktoren für ein Syndrom mit niedrigem Herzzeitvolumen nach einer Bypass-Operation der Koronararterien. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Prädiktoren des Syndroms mit niedrigem Herzzeitvolumen nach isolierter Bypass-Operation der Koronararterien: Trends über 20 Jahre. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Management des Syndroms mit niedrigem Herzzeitvolumen nach einer Operation bei angeborenen Herzfehlern. Curr Cardiol Off 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) Syndrom mit niedrigem Herzausstoß nach einer Herzoperation. J Cardiothorac Vasc 131: 291-308.
- Tibby SM., Murdoch IA (2003) Überwachung der Herzfunktion auf der Intensivstation. Arch Dis Kind 88: 46-52.
- Carcillo JA, Field AI (2002) Klinische Praxisparameter für die hämodynamische Unterstützung von pädiatrischen und neonatalen Patienten bei septischem Schock. Kritische Pflege Med 30: 1365-1378.
- Troncoso R., Pedrozo Z., Chiong M., Wang ZV, Cao DJ, Troncoso R., et al. (2011) Kardiomyozyten-Tod: Mechanismen und translationale Implikationen. Zelltod & Krankheit 2: e244.
- Tavernarakis N (2007) Kardiomyozytennekrose: alternative Mechanismen, wirksame Interventionen. Biochimica et Biophysica Acta (BBA)-Molekulare Zellforschung 1773: 480-482.
- Dorn GW (2008) Apoptotischer und nicht-apoptotischer programmierter Kardiomyozytentod bei ventrikulärem Remodelling. Cardiovasc Res 81: 465-473.Richard Conti C (1991) Das betäubte und überwinternde Myokard: ein kurzer Rückblick. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) Diastolische Herzinsuffizienz nach Herzoperation. In Koronare Herzkrankheit-Aktuelle Konzepte in Epidemiologie, Pathophysiologie, Diagnostik und Behandlung 2012. In: InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) Welche Mechanismen liegen der diastolischen Dysfunktion bei Herzinsuffizienz zugrunde? Circ Res 94: 1533-1542.Borlaug BA, Paulus WJ (2010) Herzinsuffizienz mit erhaltener Ejektionsfraktion: Pathophysiologie, Diagnose und Behandlung. Eurasien J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) Ist Phospholamban oder Troponin I die „Primadonna“ der β-adrenergen induzierten Lusitropie? Circ Res 101: 326-327. Paulus WJ, Vantrimpont PJ, Shah AM (1994) Akute Auswirkungen von Stickoxid auf die linksventrikuläre Relaxation und diastolische Dehnbarkeit beim Menschen. Beurteilung durch bikoronare Natriumnitroprussid-Infusion. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prävalenz linksventrikulärer diastolischer Füllungsabnorrnalitäten bei erwachsenen herzoperativen Patienten: Eine intraoperative echokardiographische Studie. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Träger M, et al. (2006) Biventrikuläre diastolische Füllungsmuster nach Koronararterien-Bypass-Transplantatchirurgie. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Pulmonale arterielle Hypertonie: die Schlüsselrolle der Echokardiographie. Brust 127: 1836-1843.
- Zochios V, Jones N (2014) Akutes Rechtsherzsyndrom bei kritisch kranken Patienten. Herz-Lungen-Gefäß 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Erste klinische Erfahrungen mit einer miniaturisierten transösophagealen Echokardiographiesonde auf einer kardialen Intensivstation. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenschein EH (1971) Leistung des rechten Ventrikels unter Stress: Beziehung zum rechten Koronarfluss. J Clin, 50: 2176-2183.Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Pulmonale vaskuläre und rechtsventrikuläre Dysfunktion in der Intensivpflege von Erwachsenen: Aktuelle und aufkommende Optionen für das Management: Eine systematische Literaturübersicht. Kritische Pflege 14: R169.
- Pfisterer M (2003) Rechtsventrikuläre Beteiligung bei Myokardinfarkt und kardiogenem Schock. Lanzette 362: 392-394.
- Ochiai MICH, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Prädiktoren für ein niedriges Herzzeitvolumen bei dekompensierter schwerer Herzinsuffizienz. Matthäus 66: 239-244. Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Klinisches Ergebnis einer dringenden Bypass-Transplantation der Koronararterien. J. Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Prädiktoren des Syndroms mit niedrigem Herzzeitvolumen nach isolierter Aortenklappenoperation. Auflage 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) Evaluation von Ernährungs-Screening-Tools für Patienten, die sich einer Herzoperation unterziehen müssen. Matthäus 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) Präoperative Werte von Hämoglobin und natriuretischen Peptiden vom B-Typ, jedoch keine Entzündungsmarker, sind mit der postoperativen Morbidität in der Herzchirurgie verbunden: Eine prospektive Kohortenanalysestudie. J Cardiothorac Surg 8:170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) Präoperative Gesamtlymphozytenzahl im peripheren Blut als Prädiktor für ein schlechtes Ergebnis bei Erwachsenen Herzchirurgie. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminale natriuretische Peptidspiegel vom Pro-B-Typ und frühes Ergebnis nach Herzoperation: Eine prospektive Kohortenstudie. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Nutzen von natriuretischem Peptid vom B-Typ bei der Vorhersage postoperativer Komplikationen und Ergebnisse bei Patienten, die sich einer Herzoperation unterziehen. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) Beziehung zwischen der Serumnatriumkonzentration im Blut und den klinischen Ergebnissen bei Patienten, die wegen Herzinsuffizienz ins Krankenhaus eingeliefert wurden: eine Analyse aus dem OPTIMIZE-HF-Register. Eurasien J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) Mortalität im Krankenhaus bei Patienten mit akuter dekompensierter Herzinsuffizienz, die intravenöse vasoaktive Medikamente benötigen: eine Analyse aus dem nationalen Register für akute dekompensierte Herzinsuffizienz (ADHERE). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Teammanagement von Patienten mit Herzinsuffizienz: eine Erklärung für Angehörige der Gesundheitsberufe des Cardiovascular Nursing Council der American Heart Association. Auflage 102: 2443-24456.Stevenson LW, Perloff JK (1989) Die begrenzte Zuverlässigkeit physikalischer Zeichen zur Schätzung der Hämodynamik bei chronischer Herzinsuffizienz. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) Klinische Bewertung identifiziert hämodynamische Profile, die Ergebnisse bei Patienten mit Herzinsuffizienz vorhersagen. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Medizinische Therapie des akuten Myokardinfarkts durch Anwendung hämodynamischer Teilmengen. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) Medizinische Behandlung von fortgeschrittener Herzinsuffizienz. Jama 287: 628-640. Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) Echokardiographie bei Herzinsuffizienz: Anwendungen, Nutzen und neue Horizonte. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) Echokardiographische Bewertung der Hämodynamik bei Patienten mit dekompensierter systolischer Herzinsuffizienz. Circ Cardiovasc Bildgebung 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) Empfehlungen zur Quantifizierung der Herzkammer durch Echokardiographie bei Erwachsenen: ein Update der American Society of Echocardiography und der European Association of Cardiovascular Imaging. Eur Herz J Kardiovaskuläre Bildgebung 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) Angemessenheitskriterien für die Verwendung der kardiovaskulären Bildgebung bei Herzinsuffizienz: Bericht der Literaturübersicht. Eur Herz J Kardiovaskuläre Bildgebung 16: 147-153.
- Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) Nicht-invasive kardiale Bildgebung Bewertung von Patienten mit chronischer systolischer Herzinsuffizienz: ein Bericht der European Association of Cardiovascular Imaging (EACVI). Eur Herz J 35: 3417-3425.Vazir A, Cowie MR (2012) Beurteilung der akuten dekompensierten Herzinsuffizienz: Strategien und Instrumente. Euronol 8: 128-133.
- Gray A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) Nichtinvasive Beatmung bei akutem kardiogenem Lungenödem. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) Hämodynamische Überwachung bei akuter Herzinsuffizienz. Kritische Pflege Med 36: S40-S43. Lewis PA, Ward DA, Courtney MD (2009) Die intraaortale Ballonpumpe bei der Behandlung von Herzinsuffizienz: Implikationen für die Pflegepraxis. Aust Kritische Pflege 22: 125-131.
- Slaughter MS, Singh R (2012) Die Rolle von ventrikulären Hilfsgeräten bei fortgeschrittener Herzinsuffizienz. Revista Española de Cardiologia 65: 982-985.
- Schah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) Hämodynamische Profile fortgeschrittener Herzinsuffizienz: Assoziation mit klinischen Merkmalen und Langzeitergebnissen. JOH. 7: 105-113.Loeb HS, Bredakis J, Gunner RM (1977) Überlegenheit von Dobutamin gegenüber Dopamin zur Steigerung des Herzzeitvolumens bei Patienten mit chronischer Herzinsuffizienz mit niedrigem Output. Auflage 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, et al. (2002) Wirksamkeit und Sicherheit von intravenösem Levosimendan im Vergleich zu Dobutamin bei schwerer Herzinsuffizienz mit niedrigem Output (die LIDO-Studie): eine randomisierte Doppelblindstudie. Die Lanzette 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) Low-Output-Aortenstenose mit niedrigem Gradienten bei Patienten mit depressiver linksventrikulärer systolischer Funktion: der klinische Nutzen der Dobutamin-Herausforderung im Katheterisierungslabor. Auflage 106: 809-813.Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Auswirkungen von Levosimendan gegenüber Dobutamin auf entzündliche und apoptotische Wege bei akut dekompensierter chronischer Herzinsuffizienz. Am J Cardiol 98: 102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007): Detektive. Levosimendan vs Dobutamin für Patienten mit akuter dekompensierter Herzinsuffizienz: die SURVIVE randomisierte Studie. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) Der Calciumsensibilisator Levosimendan liefert überlegene Ergebnisse gegenüber Dobutamin beim postoperativen Syndrom mit niedrigem Herzzeitvolumen. Revista Española de Cardiología (englische Ausgabe) 61: 471-479.
- Müller W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) Natriumnitroprussid bei fortgeschrittener Herzinsuffizienz mit niedrigem Output. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan im Vergleich zu einer intraaortalen Ballonpumpe bei Hochrisiko-Herzpatienten. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) Ein Vergleich des hepatischen Blutflusses von Doubutamin und Levosimendan n bei Patienten mit niedrigem Herzzeitvolumen nach einer Herzoperation: eine randomisierte kontrollierte Studie. Anaesth Intensivpflege 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Wirkung von Levosimendan auf das Syndrom mit niedrigem Herzzeitvolumen bei Patienten mit niedriger Ejektionsfraktion, die sich einer Koronararterien-Bypass-Transplantation mit kardiopulmonalem Bypass unterziehen: die randomisierte klinische Studie LICORN. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan zur hämodynamischen Unterstützung nach Herzoperationen. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendan bei Patienten mit linksventrikulärer Dysfunktion, die sich einer Herzoperation unterziehen. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) Inotrope Mittel und Vasodilatatorstrategien zur Behandlung des kardiogenen Schocks oder des Syndroms mit niedrigem Herzzeitvolumen. Die Cochrane Library. 2 : 1-10.