Zellbiologie 07: Mikrotubuli und Zellteilung
Dies sind Notizen aus Vorlesung 7 des Cell Biology Course der Harvard University.
Vorlesung 6 stellte Mikrotubuli vor, und diese Vorlesung wird ihre Rolle bei der Zellteilung diskutieren. Hier ist ein Einführungsvideo:
Überblick über den Zellzyklus
Der Zellzyklus – der Prozess der Zellteilung und –replikation – wird von einer Reihe biochemischer Schalter gesteuert, die als Zellzykluskontrollsystem bezeichnet werden.Der Zellzyklus ist in Phasen unterteilt, die in Phasen unterteilt sind – die Leute werden sich auf die „4 Phasen“ beziehen, aber dann gibt es tatsächlich 5, und die Leute benutzen auch andere Wörter, um diese Phasen zu gruppieren, und andere Wörter, um sie zu unterteilen. Ich habe mein Bestes getan, um die Beziehung zwischen diesen Begriffen in der folgenden Tabelle zusammenzufassen. (geändert/erweitert von Wikipedia):
| MOST general grouping | the supposed „4 phases” | subphases |
|---|---|---|
| non-dividing | Gap 0 (G0) | |
| interphase | Gap 1 (G1) | G1a R G1b |
| Synthesis (S) | ||
| Gap 2 (G2) | ||
| Mitosis | Mitosis (M) | prophase prometaphase metaphase anaphase telophase cytokinesis |
The der Inhalt jeder Phase ist in diesem hervorragenden Wikimedia Commons-Bild von Kelvinsong wunderschön zusammengefasst:

Die sich am schnellsten teilenden menschlichen Zellen können einen Zellzyklus in etwa 24 Stunden abschließen (G1: 9h, S: 10h, G2: 4h, M: 30 min). Hefe kann einen Zyklus in 30 Minuten beenden, und die sich am schnellsten teilenden Drosophila-Zellen benötigen nur 8 Minuten.
Zu den Hauptreglern dieses Prozesses gehören die Cycline, die die Cyclin-abhängige Kinase oder CDK regulieren. Denken Sie daran, dass Kinasen Proteine sind, die andere Proteine phosphorylieren. Die Phosphorylierung seiner Ziele durch CDK ermöglicht das Fortschreiten der Mitose. Um genau zu sein, ist der reifungsfördernde Faktor oder MPF ein obligater heterodimerer Komplex aus Cyclin B und CDK, der seine phosphorylierende Wirkung nur dann ausübt, wenn beide Proteine vorhanden sind.
Rolle der Mikrotubuli
Mikrotubuli sind während des gesamten Zellzyklus von entscheidender Bedeutung – sie organisieren zelluläre Komponenten und teilen sie in zwei Teile. Hier sind eine Reihe von Videos des Zellzyklus, die die Rolle von Mikrotubuli hervorheben:
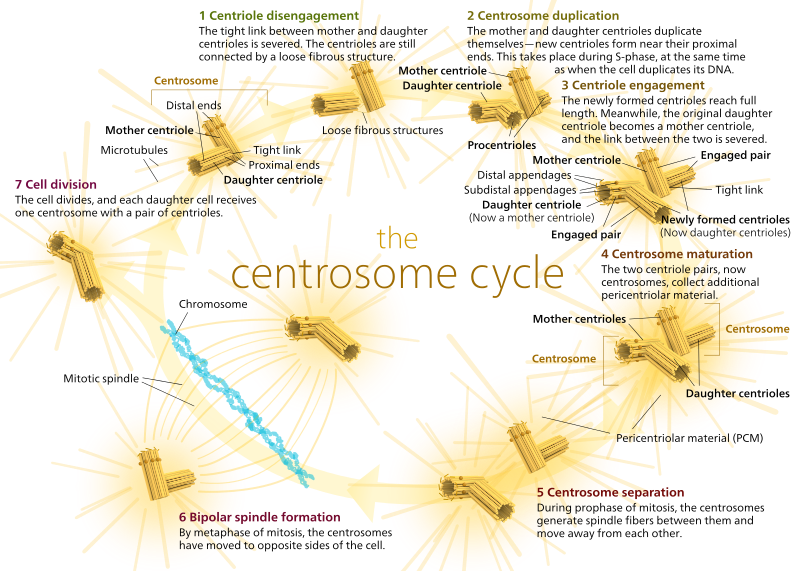
Bei Tieren haben ruhende Zellen und sogar Zellen in Interphase normalerweise nur ein MTOC, ein sogenanntes Zentrosom, das als zentraler Knotenpunkt für alle Mikrotubuli in der Zelle dient. Ein Zentrosom besteht aus zwei Zentriolen, wie unten gezeigt (nochmals vielen Dank an Kelvinsong):

Die beiden Zentriolen lösen sich voneinander und replizieren sich während der S-Phase und trennen sich dann, um entgegengesetzte „Pole“ der Zelle während der M-Phase zu bilden, so dass es jetzt zwei MTOCs gibt, von denen jedes schließlich das einzige MTOC einer neuen Zelle sein wird (ein weiteres Boss Kelvinsong-Bild):
Während der Mitose haben Sie dann die beiden „Pole“ der Zelle, jeweils mit Mikrotubuli, die am (-) Ende verankert sind und deren (+) Enden sich überlappen und in die Mitte der Zelle zeigen, wie hier gezeigt (Wikimedia Commons-Bild von Lordjuppiter):
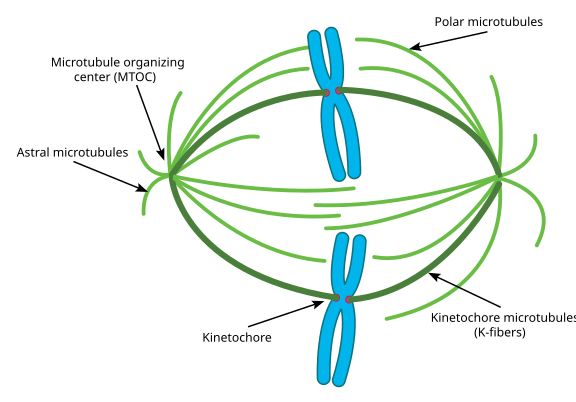
Das Ganze wird als Spindelapparat bezeichnet, und der Bereich, in dem sich die Mikrotubuli der beiden MTOCs überlappen, wird als Interdigitationszone bezeichnet. Sie werden manchmal jedes MTOC und seine Urchin-ähnliche Anordnung von Mikrotubuli hören, die als mitotische Aster bezeichnet werden.‘
Mikrotubuli in diesem Stadium sollen in drei Kategorien fallen:
- Astrale Mikrotubuli zeigen nach außen in Richtung Zellkortex, um den gesamten Spindelapparat entlang der Achse der Zellteilung zu verankern.
- Kinetochor-Mikrotubuli heften sich an den Kinetochor von Chromatiden.
- Polare Mikrotubuli, die parallel zueinander, aber in entgegengesetzte Richtungen ausgerichtet sind, sind entscheidend, um den Spindelapparat während der Mitose auseinander zu drücken. (Tatsächlich sind polare Mikrotubuli auch früher vorhanden und helfen, die Zentrosomen während der Prophase auseinander zu drücken).
Wenn Sie Fotos Diagrammen vorziehen, sehen Sie hier, wie der gesamte Spindelapparat aussieht, mit Chromatiden in Blau, Mikrotubuli in Grün und den Kinetochoren als rote Punkte:

Mikrotubuli werden während der Mitose viel dynamischer: Mehr Gamma-Tubulin fördert eine leichtere Keimbildung, aber XMAP215, ein Mikrotubuli-Stabilisator, wird während der Mitose phosphoryliert und somit inaktiviert, wodurch Kinesin-13 frei bleibt, um die Mikrotubuli zu synthetisieren. Vermögen werden schnell gemacht und verloren. Die Halbwertszeit eines Mikrotubulus während der Mitose beträgt etwa 15 Minuten, verglichen mit 30 Minuten während der Interphase. Die Menschen untersuchen die Mikrotubuli-Dynamik mit FRAP: Fügen Sie ein fluoreszierendes Mikrotubuli hinzu, bleichen Sie es und sehen Sie, wie schnell der Zusammenbau erfolgt, je nachdem, wie schnell die Fluoreszenz wieder auftritt. + Tipps spielen auch eine wichtige Rolle bei der Unterstützung und Montage der Mikrotubuli.
Kinesin-5 is hat zwei polare Köpfe, die sich an gegenüberliegende Mikrotubuli binden und versuchen, zum (+) Ende von jedem zu gehen. Dies drückt die beiden Mikrotubuli auseinander und liefert die treibende Kraft für die Trennung der MTOCs.
Zentromere DNA hat eine geringe Informationsentropie und spezielle Histone, die sich von anderem Chromatin unterscheiden. Zentromere sind ein Teil des Genoms, den Sie bei der Next-Gen-Sequenzierung fast nie aufnehmen, selbst in sehr hoher Tiefe. Das liegt daran, dass Zentromere einen anderen Zweck erfüllen als der Rest des Genoms: Die Sequenz dort ist günstig für die Interaktion mit zentromeren Proteinen und die Kinetochoranbindung. Cohesine sind Proteine, die die beiden Schwesterchromatiden zusammenhalten. Wir beziehen uns auf Kinetochor-Proteine mit zwei Schichten, dem inneren Kinetochor und dem äußeren Kinetochor.
Während der Prometaphase bewegen sich Chromosomen hin und her. Kinesine verankern die Chromosomen an den Kinetochor-Mikrotubuli jenseits der Spitze, wo Kinesin-13 die Mikrotubuli depolymerisiert, unterstützt durch einen Mangel an verfügbaren Tubulindimeren. Eine Kombination aus Motorproteinen, Mikrotubuli-wechselwirkenden Proteinen und Laufband dient dazu, die Chromosomen zu bewegen. Währenddessen wirken Dynein und Dynactin – Motorproteine, die auf das (-) Ende zulaufen – auf die astralen Mikrotubuli und ziehen die MTOCs in Richtung Zellperipherie. In der Metaphase werden die Chromatiden entlang der Metaphasenplatte ausgerichtet.
Während dieses Prozesses löst sich die Kernhülle auf und so wird der Kernimport irrelevant. Ran-GEF lokalisiert in der Nähe von Chromosomen und erzeugt hohe Konzentrationen von Ran-GTP, das Energie für einige notwendige Prozesse liefert (?).
Zellen haben einen Mechanismus zum Erfassen der Spannung in den Mikrotubuli, der ihre Anheftungschromatiden anzeigt, bevor die Mitose fortschreiten kann. Um Aneuploidie zu vermeiden, ist es wichtig, sicherzustellen, dass jedes Chromatid richtig verankert ist.
Übrigens spielen neben Mikrotubuli auch andere Zytoskelettelemente eine Schlüsselrolle im Zellzyklus. In der Zytokinese bildet Aktin einen kontraktilen Ring und teilt die Zelle mit Hilfe von Myosin-II-Motorproteinen in zwei Teile.
Bedeutung von Modellorganismen
Die Entdeckung von Zellzyklusregulationsprozessen stützte sich stark auf einige nette Merkmale populärer Modellorganismen.
Saccharomyces cerevisiae (Knospenhefe) und Schizosaccharomyces pombe (Spalthefe) können als Haploiden oder Diploiden existieren. Das ist wichtig, weil in der haploiden Phase eine Mutation ein Gen ausschalten kann – Sie müssen nicht beide Allele treffen. Und in Hefe sind viele Mutationen, insbesondere in den Cdc__ (Cell Division Control) -Genen, temperaturabhängig, wobei ein Protein mit einer Missense-Mutation bei ‚permissiven‘ Temperaturen immer noch richtig funktionieren kann, aber bei ’nicht permissiven‘ Temperaturen seine native Funktion verliert. Dies ermöglicht es, den Knockout-Phänotyp (bei der nicht permissiven Temperatur) zu untersuchen und gleichzeitig die Organismen (bei der permissiven Temperatur) leicht vermehren zu können. Das gesamte S. cerevisiae-Genom steht als Plasmidbibliotheken zur Verfügung, wodurch es möglich ist, zu screenen, welches Plasmid den Phänotyp einer bestimmten Mutante rettet. So viele Gene, die den Zellzyklus regulieren, wurden entdeckt.
In S. cerivisiae, Knospung ist Teil der Phase G1, und sobald die Tochterzelle eine bestimmte Größe erreicht hat, in einem Moment namens „START“, Die beiden verpflichten sich, in S einzutreten und letztendlich den Zellzyklus abzuschließen. Säugetierzellen haben ihren eigenen Bindungspunkt, den Restriktionspunkt oder R in G1, der analog zu START ist.
Temperaturempfindliche Cdc28-Mutanten knospen bei der nichtpermissiven Temperatur nicht. Das Cdc28-Gen kodiert das Homolog unserer Cyclin-abhängigen Kinase (CDK), die, wenn und nur wenn sie mit Cyclin komplexiert ist, andere Proteine phosphorylieren kann, um ihre Teilnahme an Zellzyklusphasen zu regulieren. Temperaturempfindliche Mutanten bei der nichtpermissiven Temperatur bleiben stecken, können nicht knospen und treten in die S-Phase ein. Stattdessen verhalten sie sich wie Wildtyp-Zellen, denen Nährstoffe entzogen sind: Sie werden groß genug, um durchzugehen, setzen sich dann aber nicht fort.Xenopus (eine Art Frosch) erwies sich als entscheidend für das Verständnis des Zellzyklus, da seine Reproduktion eine sehr große Anzahl von Zellen (z. genug Ausgangsmaterial für Western Blots, etc.), die perfekt synchronisiert sind (d. h. Alle befinden sich im selben Moment in derselben Phase des Zellzyklus. (Vergleichen Sie zum Beispiel mit Hefe, wo sich nicht alle Zellen zur gleichen Zeit in derselben Phase befinden). Auch das Ei selbst ist groß und leicht zu bearbeiten, und mehrere Zellzyklen folgen der Befruchtung. Bei Fröschen beginnen die Eier mit der meiotischen Teilung, bleiben dann aber in der G2-Phase für 8 Monate stehen, während sie an Größe zunehmen und Dinge lagern, die nach der Befruchtung für das Wachstum benötigt werden.
Zwischenfilamente
Zusätzlich zu Mikrofilamenten und Mikrotubuli haben eukaryotische Zellen auch eine Vielzahl von ‚anderen‘ Zytoskelettproteinen, die als Zwischenfilamente (IFs) bezeichnet werden. Obwohl vielfältiger als Mikrofilamente und Mikrotubuli, sind IFs nicht nur ein Sammelbegriff für ‚jedes andere Filament‘ – sie sind vielmehr eine Gruppe verwandter Proteine. Sie erstrecken sich im Allgemeinen durch das Zytoplasma und die innere Kernhülle, sind unpolar und haben keine Motorproteine, die mit ihnen assoziiert sind. Sie haben eine große Zugfestigkeit und sind sehr stabil, mit einer langsamen Austauschrate und nicht viel Abbau, obwohl Phosphorylierung ihre Demontage fördern kann. Hier sind einige beliebte Beispiele:
- Keratine kommen in Epithelzellen, Mesodermzellen und Neuronen vor. Sie geben Kraft und kommen in sauren und basischen Formen vor. Jeder kann seinen eigenen Strang bilden, aber die meisten IFs bestehen aus zwei Strängen – einem basischen und einem sauren, die irgendwie umeinander verdreht sind. Haare und Nägel bestehen aus ‚hartem‘ Keratin, das reich an Cystein für Disulfidbindungen ist und die immense Festigkeit bietet. Dauerwellen und Glätten beruhen darauf, die Disulfidbindungen zu reduzieren, das Haar umzuformen und dann die Disulfidbindungen zu reformieren. Sie haben auch ‚weiches‘ Keratin in Ihrer Haut.
- Desmins wie Vimentin kommen in mesenchymalen Zellen (Knochen, Knorpel und Fett) vor.
- Neurofilamente befinden sich in neuronalen Axonen und regulieren deren Durchmesser, was wiederum die Ausbreitungsgeschwindigkeit des Aktionspotentials bestimmt.
- Lamine sind beide am weitesten verbreitet und es wird angenommen, dass sie dem phylogenetischen Vorfahren aller anderen IFs am ähnlichsten sind. Sie bieten strukturelle Unterstützung für die Kernmembran. Sie könnten helfen, die Kernporenkomplexe zu räumen und auch die DNA zu organisieren.
Zum Schluss noch ein zusammenfassendes Video: