8.3: Orbitální Magnetický Dipólový Moment Elektronu
Vzdělávací Cíle
na konci této části, budete moci:
- Vysvětlete, proč je atom vodíku má magnetické vlastnosti
- Vysvětlete, proč energetické hladiny atomu vodíku spojena s orbitální moment hybnosti jsou rozděleny do vnějšího magnetického pole
- Použití kvantových čísel pro výpočet velikosti a směru orbitální magnetický dipólový moment atomu vodíku
V Bohrův model atomu vodíku, elektron se pohybuje po kruhové dráze kolem protonu. Elektron prochází určitým bodem na smyčce v určitém čase, takže můžeme vypočítat proud \(I = Q / t\). Elektron, který obíhá proton v atomu vodíku, je tedy analogický proudu protékajícímu kruhovým drátem (obrázek \(\PageIndex{1}\)). Při studiu magnetismu jsme viděli, že proudový drát produkuje magnetická pole. Je proto rozumné dospět k závěru, že atom vodíku vytváří magnetické pole a interaguje s jinými magnetickými poli.
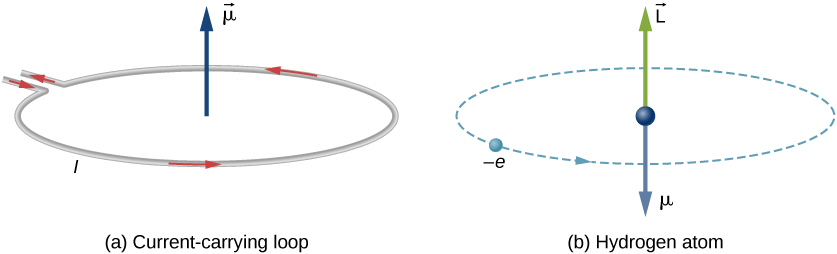
orbitální magnetický dipólový moment je měřítkem síla magnetické pole vytvářené orbitálním momentem hybnosti elektronu. Od síly a točivého momentu na proudové smyčce je velikost orbitálního magnetického dipólového momentu pro proudovou smyčku
\
kde \(I\) je proud a \(a\) je oblast smyčky. (Pro stručnost to označujeme jako magnetický moment.) Proud \(I\) spojené s elektron obíhající kolem protonu v atomu vodíku.
\
kde e je velikost náboj elektronu a \(T\) je jeho oběžná doba. Pokud budeme předpokládat, že elektron se pohybuje v dokonale kruhové oběžné dráze, oběžná doba je
\
, kde r je poloměr oběžné dráhy a v je rychlost elektronu na jeho oběžné dráze. Vzhledem k tomu, že plocha kruhu je \(\pi r^2\), absolutní magnetický moment je
\
je užitečné vyjádřit magnetického momentu μμ, pokud jde o orbitální moment hybnosti (\(\vec{L} = \vec{r} \times \vec{p}\)). Protože elektron obíhá v kruhu, vektor polohy \(\vec{r}\) a vektor hybnosti \(\vec{p}\) tvoří pravý úhel. To znamená, že velikost orbitálního momentu hybnosti je
\
Kombinuje tyto dvě rovnice,
\
V plné vektorové formě, tento výraz se zapisuje jako
\
záporné znaménko objeví, protože elektron má záporný náboj. Všimněte si, že směr magnetického momentu elektronu je antiparalelní k orbitální moment hybnosti, jak je znázorněno na Obrázku \(\PageIndex{1b}\). V Bohrově modelu atomu, je vztah mezi \(\vec{\mu}\) a \(\vec{L}\) v Rovnici \ref{BIG} je nezávislý na poloměru oběžné dráhy.
magnetický moment \(μ\) může být také vyjádřen jako orbitální Úhlové kvantové číslo \(l\). Kombinace Rovnici \ref{eq2} a Rovnice \ref{eq1}, velikost magnetický moment je
\
z-složku magnetického momentu, je,
\ &= – \left(\dfrac{e}{2m_e}\right) \, m \hbar \\ &= – \mu_B m. \label{eq6} \end{align}\]
množství \(\mu_B\) je základní jednotka magnetismu nazývá Bohrův magneton, který má hodnotu \(9.3 \times 10^{-24} \, Joule/Tesla\) (J/T) nebo \(5.8 \times 10^{-5} eV/T\). Kvantování magnetického momentu je výsledkem kvantování orbitálního momentu hybnosti.
Jak uvidíme v další části, celkový magnetický dipólový moment atomu vodíku je v důsledku orbitálního pohybu elektronu a jeho vnitřní rotaci. Prozatím ignorujeme účinek spinu elektronů.
Například \(\PageIndex{1}\): Orbitální Magnetický Dipólový Moment
Jaká je velikost orbitální dipólový magnetický moment μ elektronu v atomu vodíku v (a) stát, (b) p státu, a (c) d státě? (Předpokládejme, že rotace elektronu je nulová.)
Strategie
magnetického momentu elektronu souvisí s jeho orbitální moment hybnosti L Pro atom vodíku, toto množství se vztahuje k orbitální úhlové kvantové číslo l. Státy, které jsou uvedeny v spektroskopické notace, která se vztahuje písmeno (s, p, d, atd.) na kvantové číslo.
Řešení
velikost magnetického momentu je uveden v Rovnici \ref{eq5}:
\ &= \left(\dfrac{e}{2m_e}\right) \, \sqrt{l(l + 1)} \hbar \nonumber \\ &= \mu_B\sqrt{l(l + 1)}. \end{align}\]
- pro stav s, \(l = 0\) takže máme \(\mu = 0\) a \(\mu_z = 0\).
- Pro p státní, \(l = 0\) a \ \ kde \(m = (-1, 0, 1)\) takže \
- Pro d stavu, \(l = 2\) a získáme \ \ kde \(m = (-2, -1, 0, 1, 2)\) takže \
Význam
V y státu, není tam žádný orbitální moment hybnosti, a proto žádný magnetický moment. To neznamená, že elektron je v klidu, jen to, že celkový pohyb elektronu nevytváří magnetické pole. V p státu, elektron má magnetický moment s tři možné hodnoty pro z-složku tohoto magnetický moment; to znamená, že magnetický moment může bod ve třech různých polárních směrech—každý antiparalelní k orbitální moment hybnosti vektor. Ve stavu d má elektron magnetický moment s pěti možnými hodnotami pro z-složku tohoto magnetického momentu. V tomto případě může magnetický moment ukazovat v pěti různých polárních směrech.
atom vodíku má magnetické pole, takže očekáváme, že atom vodíku komunikovat s vnějším magnetickém poli—jako push a vytáhněte mezi dvěma tyčovými magnety. Od Síly a Točivý moment na proudovou Smyčku, víme, že když proudovou smyčku interaguje s vnějším magnetickém poli \(\vec{B}\), dojde k momentu dána tím,
\
kde I je proud, \(\vec{A}\) je oblast smyčky, \(\vec{\mu}\) je magnetický moment, a \(\vec{B}\) je vnější magnetické pole. Tento moment působí otočit magnetický moment vektoru atomu vodíku sladit s vnějším magnetickým polem. Protože mechanická práce je prováděna vnějším magnetickým polem na atomu vodíku, můžeme mluvit o energetických transformacích v atomu. Potenciální energie atomu vodíku, spojený s tímto magnetické interakce je dána Rovnicí \ref{eq30}:
\
Pokud je magnetický moment je antiparalelní k vnější magnetické pole, potenciální energie je velký, ale v případě magnetického momentu je rovnoběžný s poli, potenciální energie je malá. Práce na atomu vodíku k otáčení vektoru magnetického momentu atomu ve směru vnějšího magnetického pole je proto spojena s poklesem potenciální energie. Energie systému je však zachována, protože pokles potenciální energie produkuje záření (emise fotonu). Tyto energetické přechody jsou kvantovány, protože magnetický moment může ukazovat pouze v určitých směrech.
Pokud vnější magnetické pole bodů v kladném směru osy z, potenciální energie spojená s orbitální magnetický dipólový moment je
\
, kde \(\mu_B\) je Bohrův magneton a m je moment hybnosti projekce kvantové číslo (nebo magnetické orbitální kvantové číslo), který má hodnoty
\
například, v \(l = 1\) elektronového stavu, celková energie elektronu je rozdělena do tří různých úrovní energie odpovídající \(U = -\mu_B B, 0, \mu_B B\).
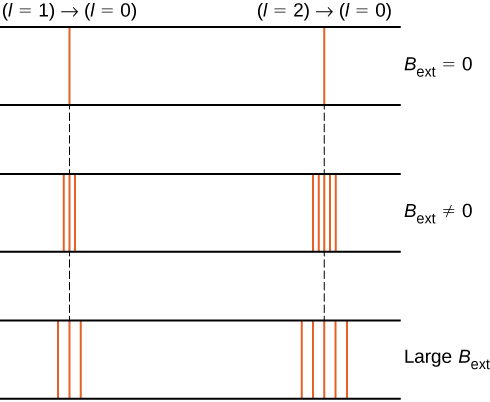
štěpení energetických hladin vnějším magnetickým polem se nazývá Zeemanův efekt. Ignoruje účinky elektronového spinu, přechody z \(l = 1\) státu do společného stavu o nižší energii vyrábět tři blízkých spektrálních čar (viz Obrázek \(\PageIndex{2}\), levý sloupec). Podobně přechody ze stavu \(l = 2\) vytvářejí pět blízce rozložených spektrálních čar (pravý sloupec). Oddělení těchto čar je úměrné síle vnějšího magnetického pole. Tento efekt má mnoho aplikací. Například rozdělení čar ve vodíkovém spektru Slunce se používá k určení síly magnetického pole Slunce. Mnoho takových měření magnetického pole lze použít k vytvoření mapy magnetické aktivity na povrchu Slunce zvané magnetogram (obrázek \(\PageIndex{3}\)).

Contributors and Attributions
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) a Bill Moebs s mnoha přispívajícími autory. Tato práce je licencována OpenStax University Physics pod licencí Creative Commons Attribution License (by 4.0).