8.3: Orbital magnetisk dipolmoment for elektronen
læringsmål
Ved udgangen af dette afsnit vil du være i stand til at:
- forklar hvorfor hydrogenatomet har magnetiske egenskaber
- forklar hvorfor energiniveauerne for et hydrogenatom forbundet med orbital vinkelmoment er opdelt af et eksternt magnetfelt
- brug kvantetal til at beregne størrelsen og retningen af det orbitale magnetiske dipolmoment for et hydrogenatom
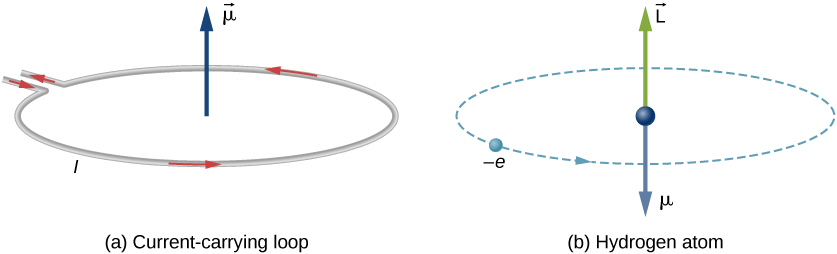
i Bohrs model af hydrogenatomet bevæger elektronen sig i en cirkulær bane omkring protonen. Elektronen passerer et bestemt punkt på sløjfen i en bestemt tid, så vi kan beregne en strøm \(I = K/t\). En elektron, der kredser om en proton i et hydrogenatom, er derfor analog med strøm, der strømmer gennem en cirkulær ledning (figur \(\Sideindeks{1}\)). I undersøgelsen af magnetisme så vi, at en strømbærende ledning producerer magnetfelter. Det er derfor rimeligt at konkludere, at hydrogenatomet producerer et magnetfelt og interagerer med andre magnetfelter.
det orbitale magnetiske dipolmoment er et mål for styrken af magnetfeltet produceret af en elektrons orbitale vinkelmoment. Fra Kraft og drejningsmoment på en strømsløjfe er størrelsen af det orbitale magnetiske dipolmoment for en strømsløjfe
\
hvor \(I\) er strømmen og \(A\) er området for sløjfen. (For korthed henviser vi til dette som det magnetiske øjeblik.) Den nuværende \(I\) forbundet med en elektron i kredsløb om en proton i et hydrogenatom er
\
hvor e er størrelsen af elektronladningen og \(T\) er dens orbitalperiode. Hvis vi antager, at elektronen bevæger sig i en perfekt cirkulær bane, er kredsløbsperioden
\
hvor r er kredsløbets radius og v er elektronets hastighed i sin bane. I betragtning af at arealet af en cirkel er \(\pi r^2\), er det absolutte magnetiske øjeblik
\
det er nyttigt at udtrykke det magnetiske momentum i form af det orbitale vinkelmoment (\(\vec{l} = \vec{r} \times \vec{p}\)). Fordi elektronen kredser i en cirkel, danner positionsvektoren \(\vec{r}\) og momentumvektoren \(\vec{p}\) en ret vinkel. Således er størrelsen af det orbitale vinkelmoment
\
Ved at kombinere disse to ligninger har vi
\
i fuld vektorform er dette udtryk skrevet som
\
det negative tegn vises, fordi elektronen har en negativ ladning. Bemærk, at retningen af elektronens magnetiske øjeblik er antiparallel til orbitalvinkelmomentet, som vist i figur \(\Sideindeks{1b}\). I Bohr-modellen af atomet er forholdet mellem \(\vec {\mu}\) og \(\vec{L}\) i ligning \ref{BIG} uafhængig af kredsløbets radius.
det magnetiske øjeblik \(l\) kan også udtrykkes i form af det orbitale vinkelkvantumtal \(l\). Ved at kombinere ligning \ref{EK2} og ligning \ref{EK1} er størrelsen af det magnetiske øjeblik
\
\&=-\left(\dfrac{e}{2m_e}\right)\, m \hbar \ \ &= – \mu_b m. \label{EK6} \end{align}\]
mængden \(\mu_b\) er en grundlæggende enhed af magnetisme kaldet Bohr Magneton, som har værdien \(9,3 \gange 10^{-24}\, Joule/Tesla\) (J/T) eller \(5,8 \gange 10^{-5} EV/t\). Kvantisering af det magnetiske øjeblik er resultatet af Kvantisering af det orbitale vinkelmoment.
som vi vil se i næste afsnit, skyldes det totale magnetiske dipolmoment af hydrogenatomet både elektronets orbitalbevægelse og dets indre spin. For nu ignorerer vi effekten af elektronspin.
eksempel \(\Sideindeks{1}\): Orbital magnetisk dipolmoment
Hvad er størrelsen af det orbital dipolmagnetiske øjeblik, der er en elektron i hydrogenatomet i (A) S-tilstand, (b) p-tilstand og (c) D-tilstand? (Antag, at elektronens spin er nul.)
strategi
elektronens magnetiske momentum er relateret til dets orbitale vinkelmoment L. For hydrogenatomet er denne mængde relateret til det orbitale vinkelkvantumnummer l. tilstandene er angivet i spektroskopisk notation, der vedrører et bogstav (s, p, d osv.) til et kvantetal.
opløsning
størrelsen af det magnetiske øjeblik er angivet i ligning \ref{EK5}:
\ &= \left(\dfrac{e}{2m_e}\right) \, \kvm{l(l + 1)} \hbar \nonumber \\ &= \Mu_b\KVRT{L(L + 1)}. \end{align}\]
- for S-tilstanden, \(l = 0\) så vi har \(\mu = 0\) og \(\mu_ = 0\).
- for P-staten, \(l = 0\) og vi har \ \ hvor \(m = (-1, 0, 1)\) så \
- for D-staten, \(l = 2\) og vi opnår \ \ hvor \(m = (-2, -1, 0, 1, 2)\) så \
betydning
I S-tilstanden er der ingen orbital vinkelmoment og derfor intet magnetisk øjeblik. Dette betyder ikke, at elektronen er i ro, bare at den samlede bevægelse af elektronen ikke producerer et magnetfelt. I P-tilstand har elektronen et magnetisk øjeblik med tre mulige værdier for å-komponenten i dette magnetiske øjeblik; dette betyder, at magnetisk øjeblik kan pege i tre forskellige polære retninger—hver antiparallel til den orbitale vinkelmomentvektor. I d-tilstand har elektronen et magnetisk øjeblik med fem mulige værdier for å-komponenten i dette magnetiske øjeblik. I dette tilfælde kan det magnetiske øjeblik pege i fem forskellige polære retninger.
et hydrogenatom har et magnetfelt, så vi forventer, at hydrogenatomet interagerer med et eksternt magnetfelt—såsom skub og træk mellem to stangmagneter. Fra Kraft og drejningsmoment på en strømsløjfe ved vi, at når en strømsløjfe interagerer med et eksternt magnetfelt \(\vec{B}\), oplever det et drejningsmoment givet af
\
hvor jeg er strømmen, \(\vec{a}\) er området for sløjfen, \(\vec{\mu}\) er det magnetiske øjeblik, og \(\vec{B}\) er det eksterne magnetfelt. Dette drejningsmoment virker til at rotere den magnetiske momentvektor af hydrogenatomet for at justere med det eksterne magnetfelt. Fordi mekanisk arbejde udføres af det eksterne magnetfelt på hydrogenatomet, kan vi tale om energitransformationer i atomet. Den potentielle energi af hydrogenatomet forbundet med denne magnetiske interaktion er givet ved ligning \ref{ek30}:
\
hvis det magnetiske øjeblik er antiparallelt med det eksterne magnetfelt, er den potentielle energi stor, men hvis det magnetiske øjeblik er parallelt med feltet, er den potentielle energi lille. Arbejde udført på hydrogenatomet for at rotere atomets magnetiske momentvektor i retning af det eksterne magnetfelt er derfor forbundet med et fald i potentiel energi. Systemets energi bevares imidlertid, fordi et fald i potentiel energi producerer stråling (emission af en foton). Disse energiovergange kvantiseres, fordi det magnetiske øjeblik kun kan pege i bestemte retninger.
Hvis det eksterne magnetfelt peger i den positive retning, er den potentielle energi forbundet med det orbitale magnetiske dipolmoment
\
hvor \(\mu_B\) er Bohr-magnetonen, og m er vinkelmomentprojektionskvantal (eller magnetisk orbital kvantetal), som har værdierne
\
for eksempel i elektrontilstanden \(l = 1\) opdeles elektronens samlede energi i tre forskellige energiniveauer svarende til \(u = -\mu_b B, 0, \mu_b B\).
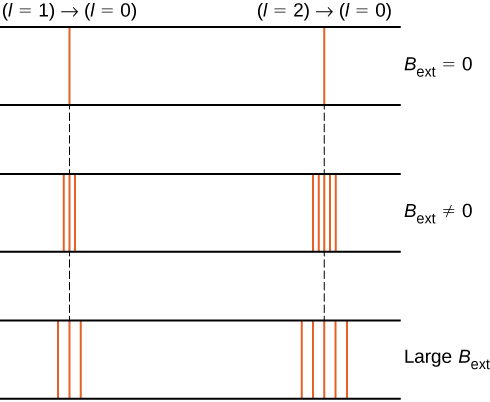
opdelingen af energiniveauer med et eksternt magnetfelt kaldes Tidseffekten. Ignorerer virkningerne af elektronspin, overgange fra \(l = 1\) tilstand til en fælles lavere energitilstand producerer tre tæt adskilte spektrale linjer (figur \(\Sideindeks{2}\), venstre kolonne). Ligeledes producerer overgange fra tilstanden \(l = 2\) Fem tæt adskilte spektrallinjer (højre kolonne). Adskillelsen af disse linjer er proportional med styrken af det eksterne magnetfelt. Denne effekt har mange applikationer. For eksempel bruges splittelsen af linjer i solens brintspektrum til at bestemme styrken af Solens magnetfelt. Mange sådanne magnetfeltmålinger kan bruges til at lave et kort over den magnetiske aktivitet på Solens overflade kaldet et magnetogram (figur \(\Sideindeks{3}\)).

bidragydere og tilskrivninger
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) og Bill Moebs med mange medvirkende forfattere. Dette værk er licenseret af