8.3 :Orbital Magnetisk Dipol Øyeblikk Av Elektronen
Læringsmål
ved slutten av denne delen vil du kunne:
- Forklar hvorfor hydrogenatomet har magnetiske egenskaper
- Forklar hvorfor energinivåene til et hydrogenatom forbundet med orbital vinkelmoment er delt av et eksternt magnetfelt
- Bruk kvante tall for å beregne størrelsen og retningen av det orbitale magnetiske dipolmomentet til et hydrogenatom
I Bohrs modell av hydrogenatomet beveger elektronen seg i en sirkulær bane rundt protonen. Elektronen passerer et bestemt punkt på løkken i en viss tid, slik at vi kan beregne en strøm \(i = Q / t\). Et elektron som kretser et proton i et hydrogenatom, er derfor analogt med strømmen som strømmer gjennom en sirkulær ledning (Figur \(\PageIndex{1}\)). I studien av magnetisme så vi at en strømbærende ledning produserer magnetfelt. Det er derfor rimelig å konkludere med at hydrogenatomet produserer et magnetfelt og interagerer med andre magnetfelt.
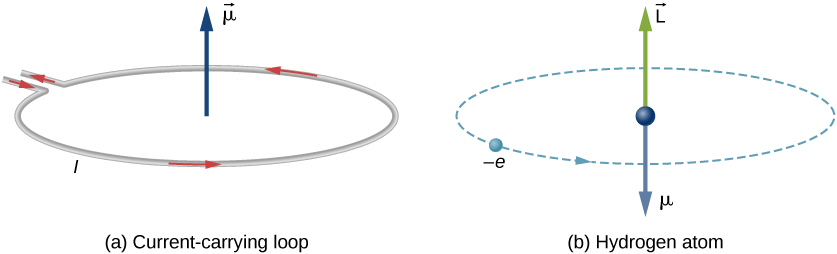
det orbitale magnetiske dipolmomentet er et mål på styrken av magnetfeltet produsert av et elektrons orbitale vinkelmoment. Fra Kraft og Dreiemoment på En Strømsløyfe er størrelsen på det orbitale magnetiske dipolmomentet for en strømsløyfe
\
hvor \(I\) er strømmen og \(A\) er området av sløyfen. (For korthet refererer vi til dette som det magnetiske øyeblikket.) Den nåværende\ (I\) forbundet med et elektron i bane om et proton i et hydrogenatom er
\
hvor e er størrelsen på elektronladningen og \(T\) er dens omløpsperiode. Hvis vi antar at elektronen beveger seg i en perfekt sirkulær bane, er orbitalperioden
\
hvor r er banens radius og v er hastigheten til elektronen i sin bane. Gitt at arealet av en sirkel er \(\pi r^2\), er det absolutte magnetiske momentet
\
Det er nyttig å uttrykke magnetisk momentum i form av orbital vinkelmoment (\(\vec {l}= \ vec {r} \times \vec {p}\)). Fordi elektronen kretser i en sirkel, danner posisjonsvektoren \(\vec{r}\) og momentumvektoren \(\vec{p}\) en rett vinkel. Dermed er størrelsen på orbitalt vinkelmoment
\
Ved Å Kombinere disse to ligningene har vi
\
i full vektorform er dette uttrykket skrevet som
\
det negative tegnet vises fordi elektronen har en negativ ladning. Legg merke til at retningen av elektronets magnetiske øyeblikk er antiparallell med orbitalt vinkelmoment, som vist I Figur \(\PageIndex{1b}\). I Bohr-modellen av atomet er forholdet mellom \(\vec{\mu}\) og \(\vec{L}\) i Ligning \ref{BIG} uavhengig av banens radius.
det magnetiske momentet \(μ\) kan også uttrykkes i form av det orbitale vinkelkvantumnummeret \(l\). Kombinere Ligning \ref{eq2} Og Ligning \ref{eq1}, er størrelsen på det magnetiske øyeblikket
\
z-komponenten av det magnetiske øyeblikket er
\ &= – \venstre(\dfrac{e}{2m_e}\høyre) \, m \hbar \\ &= – \Mu_b m. \label{eq6} \end{align}\]
mengden \(\Mu_b\) er en grunnleggende enhet av magnetisme kalt bohr magneton, som har verdien \(9.3 \ganger 10^{-24} \, joule/tesla\) (j/t) eller \(5.8 \ganger 10^{-5} ev/t\). Kvantisering av magnetisk moment er resultatet av kvantisering av orbital vinkelmoment.Som vi vil se i neste avsnitt, er det totale magnetiske dipolmomentet av hydrogenatomet på grunn av både orbitalbevegelsen til elektronen og dens indre spinn. For nå ignorerer vi effekten av elektronspinn.
Eksempel \(\PageIndex{1}\): Orbital Magnetisk Dipolmoment
hva er størrelsen på det orbitale dipolmagnetiske øyeblikket for et elektron i hydrogenatomet i (a) s-tilstanden, (b) p-tilstanden og (c) d-tilstanden? (Anta at spinnet av elektronen er null.)
Strategi
elektronets magnetiske momentum er relatert til dets orbitale vinkelmoment L. for hydrogenatomet er denne mengden relatert til det orbitale vinkelkvantumnummeret l. tilstandene er gitt i spektroskopisk notasjon, som relaterer et brev (s, p, d, etc.) til et kvantetall.
Løsning
størrelsen på det magnetiske øyeblikket er gitt i Ligningen \ref{eq5}:
\ &= \venstre(\dfrac{e}{2m_e}\høyre) \, \sqrt{l(l + 1)} \hbar \nonumber \\ &= \mu_b\sqrt{l(L + 1)}. \end{align}\]
- for s-tilstanden, \(l = 0\ ) så vi har \(\mu = 0\) og \(\mu_z = 0\).
- For p-tilstanden, \(l = 0\) og vi har \ \ hvor \ (m = (-1, 0, 1)\) så \
- for d-tilstanden, \(l = 2\) og vi får \ \ hvor \ (m = (-2, -1, 0, 1, 2)\) Så \
Betydning
I s-tilstanden er det ingen orbital vinkelmoment og derfor ingen magnetisk øyeblikk. Dette betyr ikke at elektronen er i ro, bare at den generelle bevegelsen av elektronen ikke produserer et magnetfelt. I p-tilstanden har elektronen et magnetisk moment med tre mulige verdier for z-komponenten i dette magnetiske momentet; dette betyr at magnetisk moment kan peke i tre forskjellige polare retninger-hver antiparallell til den orbitale vinkelmomentvektoren. I d-tilstanden har elektronen et magnetisk øyeblikk med fem mulige verdier for z-komponenten i dette magnetiske øyeblikket. I dette tilfellet kan det magnetiske øyeblikket peke i fem forskjellige polare retninger.et hydrogenatom har et magnetfelt, så vi forventer at hydrogenatomet interagerer med et eksternt magnetfelt—for eksempel trykk og trekk mellom to stangmagneter. Fra Kraft og Dreiemoment på En Strømsløyfe vet vi at når en strømsløyfe interagerer med et eksternt magnetfelt \(\vec{B}\), opplever det et dreiemoment gitt av
\
hvor jeg er strømmen, \(\vec{a}\) er området av sløyfen, \(\vec{\mu}\) er det magnetiske øyeblikket, og \(\vec{B}\) er det eksterne magnetfeltet. Dette dreiemomentet virker for å rotere den magnetiske momentvektoren av hydrogenatomet for å justere seg med det eksterne magnetfeltet. Fordi mekanisk arbeid utføres av det eksterne magnetfeltet på hydrogenatomet, kan vi snakke om energitransformasjoner i atomet. Den potensielle energien til hydrogenatomet forbundet med denne magnetiske interaksjonen er gitt Ved Ligning \ ref{eq30}:
\
Hvis det magnetiske øyeblikket er antiparallelt til det eksterne magnetfeltet, er potensiell energi stor, men hvis det magnetiske øyeblikket er parallelt med feltet, er potensiell energi liten. Arbeid på hydrogenatomet for å rotere atomets magnetiske moment vektor i retning av det eksterne magnetfeltet er derfor forbundet med en dråpe i potensiell energi. Energien i systemet er bevart, men fordi en dråpe i potensiell energi produserer stråling (utslipp av en foton). Disse energiovergangene er kvantisert fordi det magnetiske øyeblikket kan peke i bare bestemte retninger.hvis det eksterne magnetfeltet peker i positiv z-retning, er den potensielle energien forbundet med det orbitale magnetiske dipolmomentet
\
hvor \(\mu_B\) Er Bohr magneton og m er vinkelmomentprojeksjonskvantumnummeret (eller magnetisk orbitalkvantumnummer), som har verdiene
\
For eksempel i \(l = 1\) elektron tilstand, er den totale energien til elektronen delt inn i tre forskjellige energinivåer tilsvarer \(u = -\mu_b b, 0, \mu_b b\).
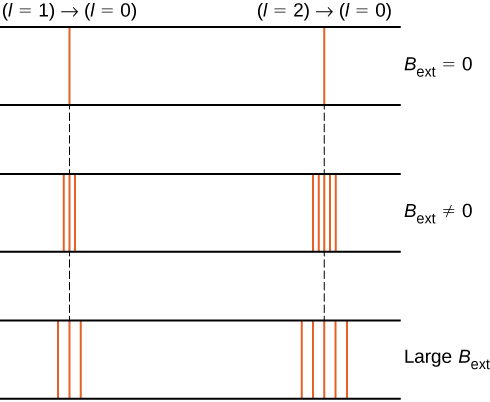
splittelsen av energinivåer ved et eksternt magnetfelt kalles Zeeman-effekten. Ignorerer effekten av elektron spinn, overganger fra \(l = 1\) tilstand til en felles lavere energitilstand produsere tre tett linjeavstand spektrallinjer (Figur \(\PageIndex{2}\), venstre kolonne). På samme måte produserer overganger fra tilstanden \(l = 2\) fem tett adskilte spektrallinjer (høyre kolonne). Separasjonen av disse linjene er proporsjonal med styrken til det eksterne magnetfeltet. Denne effekten har mange applikasjoner. For eksempel brukes splittelsen av linjer i solens hydrogenspektrum til å bestemme styrken til Solens magnetfelt. Mange slike magnetfeltmålinger kan brukes til å lage et kart over den magnetiske aktiviteten på Solens overflate kalt et magnetogram (Figur \ (\PageIndex{3}\)).

Bidragsytere og Attribusjoner
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), Og Bill Moebs med mange bidragsytere. Dette verk er lisensieret af OpenStax University Physics under En Creative Commons Navngivelse (Av 4.0).