8.3: momento Orbital do dipolo magnético do electrão
objectivos de aprendizagem
:
- Explique por que o átomo de hidrogênio tem propriedades magnéticas
- a Explicar por que os níveis de energia de um átomo de hidrogênio associado com orbital angular momentum são divididos por um campo magnético externo
- Use números quânticos para calcular a magnitude e a direção do orbital momento dipolar magnético de um átomo de hidrogênio
No modelo de Bohr do átomo de hidrogênio, o elétron se move em uma órbita circular em torno do próton. O elétron passa por um ponto particular no loop em um certo tempo, para que possamos calcular um \atual (I = Q / t\). Um elétron que orbita um próton em um átomo de hidrogênio é, portanto, análogo à corrente que flui através de um fio circular (figura \(\PageIndex{1}\)). No estudo do magnetismo, vimos que um fio de transporte de corrente produz campos magnéticos. É, portanto, razoável concluir que o átomo de hidrogénio produz um campo magnético e interage com outros campos magnéticos.
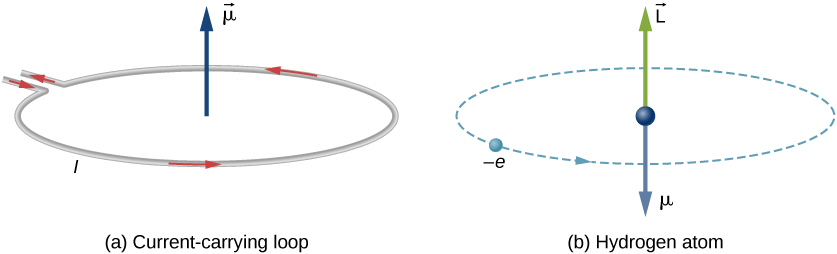
o momento orbital do dipolo magnético é uma medida da força do campo magnético produzido pelo momento angular orbital de um elétron. A partir da força e Torque em um Loop atual, a magnitude do momento do dipolo orbital para um loop atual é
\
onde \(i\) é a corrente e \(a\) é a área do loop. (Para brevidade, referimo-nos a isto como o momento magnético.) The current \(i\) associated with an electron in orbit about a proton in a hydrogen atom is
\
where e is the magnitude of the electron charge and \(T\) is its orbital period. Se partirmos do princípio de que o elétron viaja em uma órbita perfeitamente circular, o período orbital é
\
, onde r é o raio da órbita e v é a velocidade do elétron em sua órbita. Dado que a área de um círculo é \(\pi r^2\), a absoluta momento magnético é
\
é útil para expressar o impulso magnético μμ em termos do momento angular orbital (\(\vec{L} = \vec{r} \times \vec{p}\)). Como o elétron orbita em um círculo, o vetor de posição \(\vec{r}\) e o vetor de momento \(\vec{p}\) formam um ângulo reto. Assim, a magnitude do momento angular orbital é
\
a Combinação destas duas equações, temos
\
Em plena forma vetorial, esta expressão é escrito como
\
O sinal negativo aparece porque o elétron possui uma carga negativa. Observe que a direção do momento magnético do elétron é antiparalel ao momento angular orbital, como mostrado na figura \(\PageIndex{1b}\). No modelo de Bohr do átomo, a relação entre \(\vec{\mu}\) e \(\vec{L}\) na Equação \ref{GRANDE} é independente do raio da órbita.
O momento magnético \(μ\) também pode ser expresso em termos do número quântico angular orbital \(l\). Combinando a Equação \ref{eq2} e a Equação \ref{eq1}, a magnitude do momento magnético é
\
O componente-z do momento magnético é
\ &= – \left(\dfrac{e}{2m_e}\right) \, m \hbar \\ &= – \mu_B m. \label{eq6} \end{align}\]
A quantidade de \(\mu_B\) é uma unidade fundamental do magnetismo chamado o magneton de Bohr, que tem o valor de \(9.3 \times 10^{-24} \, Joule/Tesla\) (J/T) ou \(5.8 \times 10^{-5} eV/T\). Quantização do momento magnético é o resultado da quantização do momento angular orbital.como veremos na próxima seção, o momento do dipolo magnético total do átomo de hidrogênio é devido ao movimento orbital do elétron e seu spin intrínseco. Por agora, ignoramos o efeito do spin electrónico.
exemplo \(\PageIndex{1}\): Orbital Magnetic Dipole Moment
Qual é a magnitude do orbital dipole magnetic moment μ of an electron in the hydrogen atom in the (A) s state, (b) p state, and (C) d state? (Suponha que o spin do elétron é zero.)
estratégia
O momento magnético do elétron está relacionado com o seu momento angular orbital L. para o átomo de hidrogênio, esta quantidade está relacionada com o número quântico angular orbital l. os estados são dados em notação espectroscópica, que relaciona uma letra (s, p, d, etc. ) para um número quântico.
Solução
A magnitude do momento magnético é dado na Equação \ref{eq5}:
\ &= \left(\dfrac{e}{2m_e}\right) \, \sqrt{l(l + 1)} \hbar \nonumber \\ &= \mu_B\sqrt{l(l + 1)}. \end{align}\]
- para o estado s, \(l = 0\) por isso temos \(\mu = 0\) e \(\mu_z = 0\).
- Para o estado p, \(l = 0\) e temos \ \ que \(m = (-1, 0, 1)\) assim \
- Para o estado d, \(l = 2\) e obtemos \ \ que \(m = (-2, -1, 0, 1, 2)\) assim \
Significância
No s do estado, não há orbital angular momentum e, portanto, nenhum momento magnético. Isto não significa que o elétron esteja em repouso, apenas que o movimento geral do elétron não produz um campo magnético. No estado p, o elétron tem um momento magnético com três valores possíveis para o z-componente do momento magnético; isto significa que o momento magnético pode apontar em três diferentes polar direções—cada antiparallel para o orbital angular momentum vetor. No Estado d, o elétron tem um momento magnético com cinco valores possíveis para o componente z deste momento magnético. Neste caso, o momento magnético pode apontar em cinco direções polares diferentes.
um átomo de hidrogénio tem um campo magnético, pelo que esperamos que o átomo de hidrogénio interaja com um campo magnético externo—como a pressão e a tracção entre dois ímanes de barras. De Força e Torque em um Loop de Corrente, nós sabemos que quando um loop de corrente interage com um campo magnético externo \(\vec{B}\), ele experimenta um torque dado por
\
, onde I é a corrente, \(\vec{A}\) é a área do loop, \(\vec{\mu}\) é o momento magnético, e \(\vec{B}\) é o campo magnético externo. Este torque atua para rodar o vetor momento magnético do átomo de hidrogênio para se alinhar com o campo magnético externo. Como o trabalho mecânico é feito pelo campo magnético externo do átomo de hidrogênio, podemos falar sobre transformações de energia no átomo. O potencial de energia do átomo de hidrogênio associado a esta interação magnética é dada pela Equação \ref{eq30}:
\
Se o momento magnético é antiparallel para o campo magnético externo, a energia potencial é grande, mas se o momento magnético é paralelo ao campo, o potencial de energia é pequena. O trabalho realizado no átomo de hidrogênio para rodar o vetor do momento magnético do átomo na direção do campo magnético externo é, portanto, associado a uma queda na energia potencial. A energia do sistema é conservada, no entanto, porque uma queda na energia potencial produz radiação (a emissão de um fóton). Estas transições de energia são quantizadas porque o momento magnético pode apontar em apenas certas direções.
Se o campo magnético externo pontos positivos z-direção, a energia potencial associada com o orbital magnético momento dipolar é
\
onde \(\mu_B\) é o magneton de Bohr e m é o momento angular de projeção quantum número (ou magnético orbital quantum número), que tem como valores
\
Por exemplo, em a \(l = 1\) elétron do estado, a energia total do elétron é dividida em três distintos níveis de energia correspondentes a \(U = -\mu_B B, 0, \mu_B B\).
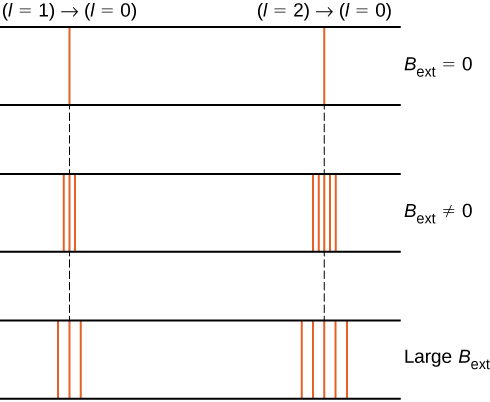
the splitting of energy levels by an external magnetic field is called the Zeeman effect. Ignorando os efeitos do spin electrónico, as transições do estado \(l = 1\) para um estado de energia inferior comum produzem três linhas espectrais espaçadas (figura \(\PageIndex{2}\), coluna da esquerda). Da mesma forma, as transições do estado \(l = 2\) produzem cinco linhas espectrais espaçadas (coluna direita). A separação destas linhas é proporcional à força do campo magnético externo. Este efeito tem muitas aplicações. Por exemplo, a divisão de linhas no espectro de hidrogênio do sol é usada para determinar a força do campo magnético do sol. Muitas dessas medidas de campo magnético podem ser usadas para fazer um mapa da atividade magnética na superfície do sol chamado magnetograma (figura \(\PageIndex{3}\)).

contribuintes e atribuições
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), e Bill Moebs com muitos autores contribuintes. Este trabalho é licenciado pela Universidade de Física da OpenStax sob uma licença Creative Commons Attribution (por 4.0).