8.3 :momentul dipolului Magnetic Orbital al electronului
obiective de învățare
până la sfârșitul acestei secțiuni, veți putea:
- explicați de ce atomul de hidrogen are proprietăți magnetice
- explicați de ce nivelurile de energie ale unui atom de hidrogen asociate cu impulsul unghiular orbital sunt împărțite de un câmp magnetic extern
- utilizați numere cuantice pentru a calcula magnitudinea și direcția momentului dipol magnetic orbital al unui atom de hidrogen
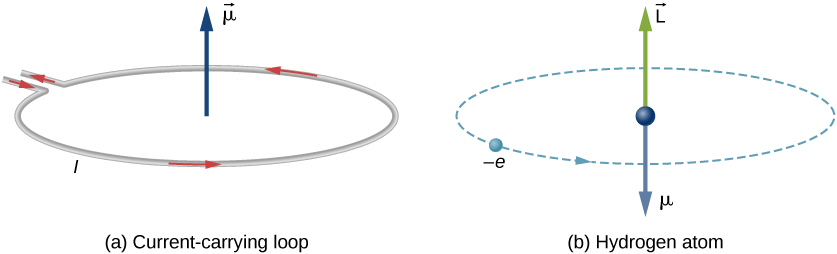
în modelul atomului de hidrogen al lui Bohr, electronul se mișcă într-o orbită circulară în jurul protonului. Electronul trece printr-un anumit punct de pe buclă într-un anumit timp, astfel încât să putem calcula un curent \(i = Q/t\). Un electron care orbitează un proton într-un atom de hidrogen este, prin urmare, Analog curentului care curge printr-un fir circular (figura \(\PageIndex{1}\)). În studiul magnetismului, am văzut că un fir purtător de curent produce câmpuri magnetice. Prin urmare, este rezonabil să se concluzioneze că atomul de hidrogen produce un câmp magnetic și interacționează cu alte câmpuri magnetice.
momentul dipolului magnetic orbital este o măsură a rezistenței câmpului magnetic produs de impulsul unghiular orbital al unui electron. Din forță și cuplu pe o buclă de curent, magnitudinea momentului dipol magnetic orbital pentru o buclă de curent este
\
unde \(I\) este curentul și \(A\) este aria buclei. (Pentru concizie, ne referim la acest lucru ca moment magnetic.) Curentul\ (I\) asociat cu un electron pe orbită în jurul unui proton dintr-un atom de hidrogen este
\
unde e este magnitudinea sarcinii electronice și\ (T\) este perioada sa orbitală. Dacă presupunem că electronul călătorește într-o orbită perfect circulară, perioada orbitală este
\
unde r este raza orbitei și v este viteza electronului pe orbita sa. Având în vedere că aria unui cerc este \(\pi r^2\), momentul magnetic absolut este
\
este util să se exprime impulsul magnetic în termeni de impuls unghiular orbital (\(\vec{L} = \vec{r} \times \vec{p}\)). Deoarece electronul orbitează într-un cerc, vectorul de poziție \(\vec{r}\) și vectorul impuls \(\vec{p}\) formează un unghi drept. Astfel, magnitudinea momentului unghiular orbital este
\
combinând aceste două ecuații, avem
\
în formă vectorială completă, această expresie este scrisă ca
\
semnul negativ apare deoarece electronul are o sarcină negativă. Observați că direcția momentului magnetic al electronului este antiparalel la momentul unghiular orbital, așa cum se arată în figura \(\PageIndex{1b}\). În modelul Bohr al atomului, relația dintre \(\vec {\mu}\) și \(\vec{L}\) în ecuația \ref{BIG} este independentă de raza orbitei.
momentul magnetic \(XV\) poate fi exprimat și în termenii numărului cuantic unghiular orbital \(l\). Combinând ecuația \ref{eq2} și ecuația \ref{eq1}, magnitudinea momentului magnetic este
\
componenta z a momentului magnetic este
\ &=-\left(\dfrac{e}{2m_e}\right) \, m \hbar \\ &= – \mu_b M. \Label{EQ6} \end{align}\]
cantitatea \(\mu_b\) este o unitate fundamentală de magnetism numită Magneton Bohr, care are valoarea \(9,3 \ori 10^{-24} \, Joule/Tesla\) (J/T) sau \(5,8 \ori 10^{-5} EV/t\). Cuantificarea momentului magnetic este rezultatul cuantizării momentului unghiular orbital.
după cum vom vedea în secțiunea următoare, momentul dipol magnetic total al atomului de hidrogen se datorează atât mișcării orbitale a electronului, cât și spinului său intrinsec. Deocamdată, ignorăm efectul rotirii electronilor.
Example \(\PageIndex{1}\): momentul dipolului Magnetic Orbital
care este magnitudinea momentului magnetic dipol orbital al unui electron din atomul de hidrogen în starea (a) s, (B) P și starea (c) d? (Să presupunem că spinul electronului este zero.)
strategie
impulsul magnetic al electronului este legat de impulsul său unghiular orbital L. pentru atomul de hidrogen, această cantitate este legată de numărul cuantic unghiular orbital l. stările sunt date în notație spectroscopică, care raportează o literă (S, p, d etc.) la un număr cuantic.
soluție
magnitudinea momentului magnetic este dată în ecuația \ref{eq5}:
\&= \stânga(\dfrac{e}{2m_e}\dreapta) \, \sqrt{L(L + 1)} \hbar \nonumber \ \ &= \mu_b\sqrt{L(L + 1)}. \ end{align}\]
- pentru starea s, \(l = 0\) deci avem \(\mu = 0\) și \(\mu_z = 0\).
- pentru starea p, \(L = 0\) și avem \ \ unde \(m = (-1, 0, 1)\) deci \
- pentru starea d, \(l = 2\) și obținem \ \ unde \(m = (-2, -1, 0, 1, 2)\) deci \
semnificație
În starea s, nu există un moment unghiular orbital și, prin urmare, nici un moment magnetic. Aceasta nu înseamnă că electronul este în repaus, ci doar că mișcarea generală a electronului nu produce un câmp magnetic. În starea p, electronul are un moment magnetic cu trei valori posibile pentru componenta z a acestui moment magnetic; aceasta înseamnă că momentul magnetic poate indica în trei direcții polare diferite-fiecare antiparalel la vectorul momentului unghiular orbital. În starea d, electronul are un moment magnetic cu cinci valori posibile pentru componenta z a acestui moment magnetic. În acest caz, momentul magnetic poate indica în cinci direcții polare diferite.
un atom de hidrogen are un câmp magnetic, așa că ne așteptăm ca atomul de hidrogen să interacționeze cu un câmp magnetic extern—cum ar fi împingerea și tragerea între doi magneți de bare. Din forța și cuplul pe o buclă de curent, știm că atunci când o buclă de curent interacționează cu un câmp magnetic extern \(\vec{b}\), ea experimentează un cuplu dat de
\
unde I este curentul, \(\vec{a}\) este aria buclei, \(\vec{\mu}\) este momentul magnetic și \(\vec{B}\) este câmpul magnetic extern. Acest cuplu acționează pentru a roti vectorul momentului magnetic al atomului de hidrogen pentru a se alinia cu câmpul magnetic extern. Deoarece munca mecanică se face prin câmpul magnetic extern pe atomul de hidrogen, putem vorbi despre transformările energetice din atom. Energia potențială a atomului de hidrogen asociată cu această interacțiune magnetică este dată de ecuația \ ref{eq30}:
\
Dacă momentul magnetic este antiparalel la câmpul magnetic extern, energia potențială este mare, dar dacă momentul magnetic este paralel cu câmpul, energia potențială este mică. Lucrările efectuate pe atomul de hidrogen pentru a roti vectorul momentului magnetic al atomului în direcția câmpului magnetic extern sunt, prin urmare, asociate cu o scădere a energiei potențiale. Energia sistemului este conservată, totuși, deoarece o scădere a energiei potențiale produce radiații (emisia unui foton). Aceste tranziții de energie sunt cuantificate deoarece momentul magnetic poate indica doar anumite direcții.
dacă câmpul magnetic extern indică în direcția z pozitivă, energia potențială asociată momentului dipol magnetic orbital este
\
unde \(\mu_B\) este magnetonul Bohr și m este numărul cuantic de proiecție a momentului unghiular (sau numărul cuantic orbital magnetic), care are valorile
\
de exemplu, în starea de electroni \(l = 1\), energia totală a electronului este împărțită în trei niveluri de energie distincte corespunzător lui \(u = -\mu_b B, 0, \mu_b b\).
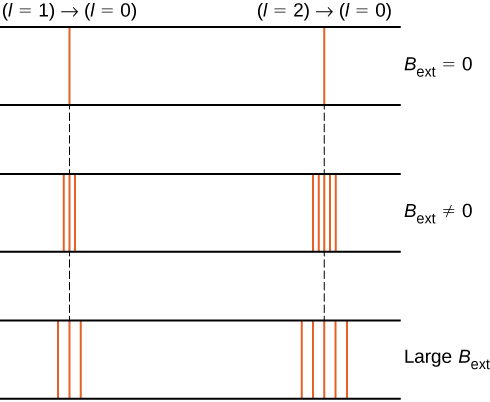
divizarea nivelurilor de energie de către un câmp magnetic extern se numește efectul Zeeman. Ignorând efectele spinului electronilor, tranzițiile de la starea \(l = 1\) la o stare comună de energie inferioară produc trei linii spectrale strâns distanțate (figura \(\PageIndex{2}\), coloana din stânga). La fel, tranzițiile de la starea \(l = 2\) produc cinci linii spectrale strâns distanțate (coloana din dreapta). Separarea acestor linii este proporțională cu puterea câmpului magnetic extern. Acest efect are multe aplicații. De exemplu, împărțirea liniilor în spectrul de hidrogen al Soarelui este utilizată pentru a determina puterea câmpului magnetic al Soarelui. Multe astfel de măsurători ale câmpului magnetic pot fi folosite pentru a face o hartă a activității magnetice la suprafața Soarelui numită magnetogramă (figura \(\PageIndex{3}\)).

colaboratori și atribuții
Samuel J. Ling (Universitatea de Stat Truman), Jeff Sanny (Universitatea Loyola Marymount) și Bill Moebs cu mulți autori care contribuie. Această lucrare este licențiată de OpenStax University Physics sub o licență Creative Commons Attribution (by 4.0).