eiwitvertering: stappen, enzymen en hormonen
het lichaam heeft eiwitten nodig, en met name de essentiële aminozuren die erin zitten. De aanbevolen dagelijkse inname voor een gezonde volwassen persoon is 0,85 g/kg lichaamsgewicht, dus voor een 70 kg persoon is ongeveer 60 g, maar vaak in de typische westerse voeding is de inname groter dan 100 g / dag.
naast voedseleiwitten verteert het lichaam ook 50-100 g endogene eiwitten die worden uitgescheiden of verloren in het lumen van het maagdarmkanaal en die het resultaat zijn van:
- speeksel;
- maagsap;
- pancreasenzymen en andere secreties;
- darmcellen die afbladeren;
- eiwitten die vanuit de bloedbaan naar het darmlumen gaan.
dit mengsel wordt efficiënt verteerd en geabsorbeerd in de twaalfvingerige darm, het eerste en het kortste deel van de dunne darm, met een dagelijks verlies via de feces van ongeveer 1,6 g stikstof, overeenkomend met 10 g eiwit. Het grootste deel van de verloren stikstof wordt gebruikt door de microflora in de dikke darm voor zijn groei, en dus wordt gevonden in de feces als onderdeel van de bacteriële massa.
inhoud
- spijsverteringsenzymen
- rol van het koken en kauwen van voedsel
- stadia van eiwitvertering
- maag-en eiwitvertering
- eiwitvertering en pepsine
- twaalfvingerige darm en eiwitvertering
- activering van zymogenen in de pancreas
- trypsine-remmer
- /li>
spijsverteringsenzymen
eiwitvertering vindt plaats als gevolg van de hydrolyse van de peptidebindingen die de individuele aminozuren in de polypeptideketen binden. Deze reacties worden gekatalyseerd door enzymen die proteasen worden genoemd.
de intestinale proteasen, specifiek voor de aminozuurzijketen, zijn hydrolasen die in twee klassen kunnen worden onderverdeeld:- endopeptidasen, die peptidebindingen binnen de polypeptideketen hydrolyseren en worden geproduceerd door de maag en de exocriene alvleesklier;
- exopeptidasen, die in twee groepen kunnen worden onderverdeeld:
De carboxypeptidase, die aminozuren uit het C-terminale uiteinde verwijderen, en worden geproduceerd door de exocriene pancreas;
De aminopeptidase, die inwerken op het n-terminale uiteinde, en worden geproduceerd door de enterocyten.
activering van Chymotrypsinogeen deze enzymen worden gesynthetiseerd en uitgescheiden in een inactieve vorm, zymogenen of proenzymes genoemd.
in de cel worden zymogenen opgeslagen in membraangebonden granulaten, zymogen granulaten genaamd. Wanneer de cel door het specifieke signaal wordt bevorderd, wordt het korrelmembraan met het plasmamembraan en zymogens vrijgegeven door exocytose.
Deze proteasen worden gesynthetiseerd in een inactieve vorm om te voorkomen dat ze, voordat ze worden uitgescheiden, zichzelf en/of weefseleiwitten verteren. Wat er gebeurt is dat de actieve plaats van het enzym wordt “gemaskeerd” en pas na activering kan het eiwit op het substraat inwerken. De activering is het resultaat van de splitsing, gekatalyseerd door een specifiek enzym, van één of meer specifieke peptidebindingen, met vrijgave van één of meer segmenten van de polypeptideketen. Dit staat de molecule toe om een driedimensionale bouw aan te nemen waarin de actieve plaats vrij is en behoorlijk wordt gevormd.zelfs hun accumulatie in het granulaat is een beschermingssysteem: het isoleert ze van de andere moleculen die in de cel aanwezig zijn.de meeste proteïnen in hun oorspronkelijke bouw zijn resistent tegen de werking van proteasen. Dit is een gevolg van hun secundaire en tertiaire of inheemse structuur die vele banden aan de actie van de enzymen maskeren. Deze structuren worden gestabiliseerd door covalente bindingen, zoals disulfidebruggen tussen cysteïne-residuen, en niet-covalente krachten, zoals Ionische interacties, waterstofbindingen en van der Waals-krachten.
voor een adequate eiwitvertering is het daarom essentieel dat peptidebindingen zo toegankelijk mogelijk zijn voor de werking van de intestinale proteasen. Dit wordt bereikt, buiten het lichaam door het koken van voedsel, en binnen het lichaam door de zure omgeving in de maag.rol van het koken en kauwen van voedsel
het koken van voedsel, wanneer het niet overmatig is, vergemakkelijkt de eiwitvertering.
Op welke manier?zoals alle moleculen zijn ook eiwitten niet bewegingloos, maar vibreren ze. Aangezien de temperatuur toeneemt trillen de proteã nen bij een grotere amplitude, omhoog om de niet-kovalente banden te vernietigen die tot het onderhoud van de inheemse structuur bijdragen. Daarom komt een conformational verandering van de proteã Ne voor, dat wil zeggen, de molecule wordt gedenatureerd. Dit kan interne peptide banden toegankelijker maken voor de werking van spijsverteringsenzymen.zelfs het kauwen en de insalivatie van voedsel homogeniseren en bevochtigen de vaste bestanddelen van het voedsel zelf, waardoor de spijsvertering in de maag en de dunne darm wordt vergemakkelijkt.stadia van eiwitvertering
twee stadia zijn betrokken bij de vertering van eiwitten: de eerste treedt op in de maag en de andere in de twaalfvingerige darm, het eerste deel van de dunne darm.
maag-en eiwitvertering
eiwitvertering begint in de maag, en dit is een “voorbereidingsfase” in vergelijking met de gebeurtenissen die optreden in de twaalfvingerige darm.de aanwezigheid van voedsel in de maag stimuleert de G-cellen van het slijmvlies van het antrum van de maag en het proximale duodenum om het hormoon gastrine aan te maken en af te geven in de bloedbaan. Het hormoon stimuleert de pariëtale cellen van de juiste maagklieren, meestal gelokaliseerd op de bodem van het orgaan, om zoutzuur te produceren en af te scheiden in de maag (pariëtale cellen produceren ook de intrinsieke factor, een eiwit dat vitamine B12 bindt, het voorkomen van de vernietiging ervan en waardoor het kan worden geabsorbeerd).
In de juiste maagklieren vond u ook:- muceuze halscellen, die slijm produceren;
- hoofdcellen, die pepsinogeen afgeven.
al deze stoffen, samen met andere stoffen zoals kaliumionen en maaglipase, zijn aanwezig in het maagsap, dat een pH heeft van 1 tot 2,5.door zijn lage pH heeft het maagsap een antiseptische werking, die de meeste bacteriën en andere vreemde cellen doodt, en een denaturerend effect, omdat het de niet-kovalente bindingen breekt die de inheemse structuur van eiwitten behouden. Dit denaturerende effect vergemakkelijkt de toegang van intestinale protease tot peptidebindingen, zoals de verwarming tijdens het koken. Sommige proteã nen rijk aan disulfidebanden, zoals keratins, zijn bestand tegen denaturatie door lage pH, en vandaar moeilijk te verteren. Integendeel, de meeste bolvormige eiwitten worden bijna volledig gehydrolyseerd tot samenstellende aminozuren.ten slotte activeert de lage pH van het maagsap pepsinogeen, een zymogeen, tot pepsine, het eerste enzym dat betrokken is bij de eiwitvertering.
eiwitvertering en pepsine
Er zijn verschillende iso-enzymen van pepsinogeen, zoals type I, gesynthetiseerd door de cellen van het lichaam en fundus van de maag, en type II, dat in alle regio ‘ s van het orgaan wordt geproduceerd. Alle iso-enzymen worden omgezet in het actieve enzym. De activering vindt plaats via autokatalyse, bij pH-waarden lager dan 5, door een intramoleculair proces dat bestaat uit de hydrolyse van een specifieke peptidebinding en de afgifte van een klein peptide uit het n-terminale uiteinde van het pro-enzym. Dit peptide blijft gebonden aan het enzym en blijft als inhibitor dienst doen totdat de pH onder 2 daalt, of totdat het verder door pepsine zelf wordt afgebroken. Dus, zodra wat pepsine wordt gevormd, activeert dit snel andere pepsinogeenmoleculen.pepsine, een endopeptidase met een optimale pH-activiteit bij 1,6, hydrolyseert 10-20% van de eiwitten in de maaltijd. Vele spijsverteringsenzymen kunnen op een brede waaier van substraten handelen, en pepsine is geen uitzondering, die de splitsing van peptidebindingen naast aminozuurresiduen zoals leucine en phenylalanine, tyrosine en tryptofaan (aromatische aminozuren) katalyseert. Een mengsel van peptides van grote grootte en een paar vrij aminozuur worden geproduceerd.pepsinewerking is niet zozeer van belang vanwege de directe bijdrage aan de eiwitvertering, die bescheiden is, maar voor de afgifte van peptiden en aminozuren die, op het niveau van de twaalfvingerige darm, de secretie van cholecystokinine stimuleren, en dus de duodenale/pancreasfase van de eiwitvertering (zie hieronder).
opgemerkt moet worden dat de werking van pepsine op collageen, een familie van eiwitten die de spiercellen wikkelen en bij elkaar houden, de toegang van het pancreasprotease tot meeleiwitten vergemakkelijkt.twaalfvingerige darm en eiwitvertering
wanneer de maaginhoud in het twaalfvingerige darm overgaat, stimuleert de zuurgraad van de maag de cellen, gelokaliseerd in het twaalfvingerige darmslijmvlies en in het proximale deel van het jejunum (het volgende deel van de dunne darm), om het hormoon secretine aan te maken en af te geven in de bloedbaan. Het hormoon veroorzaakt de afscheiding van een alkalisch pancreassap, rijk aan bicarbonaationen maar arm aan enzymen, die in de twaalfvingerige darm via het pancreaskanaal overgaat. In de twaalfvingerige darm neutraliseert het zoutzuur dat door de maag wordt geproduceerd en verhoogt het de pH tot ongeveer 7 (neutrale niveaus). Secretin stimuleert ook de galafscheiding en vermindert de gastrineafgifte.de aanwezigheid van aminozuren in de twaalfvingerige darm stimuleert, zoals hierboven vermeld, endocriene cellen in de twaalfvingerige darm en het jejunum om cholecystokinine (CKK) aan te maken en af te geven in de bloedbaan. Het hormoon stimuleert onder andere de exocriene alvleesklier om een sap rijk aan enzymen (aanwezig als zymogenen) af te scheiden, dat wil zeggen:
- trypsinogeen, chymotrypsinogeen en proelastase, endopeptidasen met een andere substraatspecificiteit dan pepsine, maar ook onder hen;
- procarboxypeptidase A en B, exopeptidasen die aminozuren verwijderen uit het C-terminale uiteinde van de peptiden.
daarom is er in de twaalfvingerige darm een neutrale omgeving rijk aan enzymen die in staat is om, eenmaal geactiveerd, de eiwitvertering voort te zetten. Bovendien, aangezien proteases verschillende substraatspecificiteit hebben, kan elk peptide door een enzym worden geproduceerd substraat van een ander enzym zijn.in pancreassap zijn ook amylase, lipase en nuclease aanwezig.
activering van zymogenen in de pancreas
de eerste en belangrijkste stap in hun activering is de conversie van trypsinogeen naar trypsine door enteropeptidase (ook enterokinase genoemd), een endopeptidase geproduceerd door cellen van de twaalfvingerige darm na cholecystokinine stimulatie. Enteropeptidase katalyseert de splitsing van een specifieke peptide binding tussen een lysineresidu en een isoleucineresidu van het trypsinogeen, met afgifte van een hexapeptide. Dit veroorzaakt een conformational herschikking van de proteã ne die het activeert, dat wil zeggen, trypsine wordt gevormd.het enzym splitst peptidebindingen naast lysine-en arginineresiduen van eiwit om te verteren; bovendien kan het chymotrypsinogeen, proelastase en procarboxypeptidase A en B activeren, maar ook andere trypsinogeen-moleculen, zoals pepsine (autocatalyse).
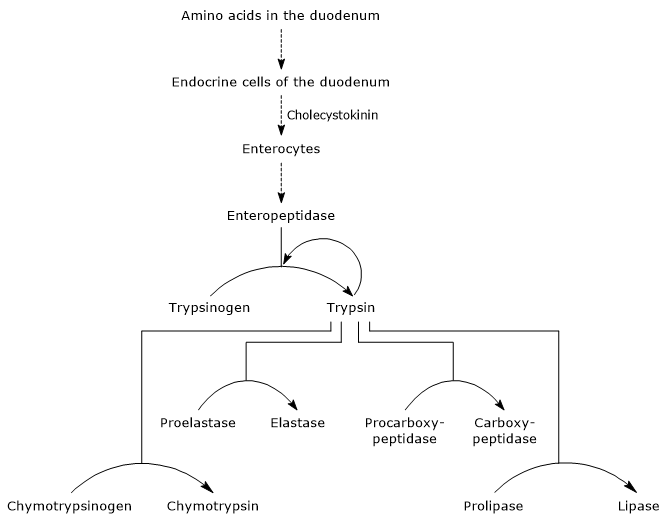
daarom neemt het vermogen van de twaalfvingerige darm om eiwitten te verteren toe naarmate de zymogenen in de pancreas worden geactiveerd, allemaal veroorzaakt door een kleine hoeveelheid enteropeptidase.
- de activering van chymotrypsinogeen op chymotrypsine gebeurt door verschillende stappen waaraan trypsine en de geactiveerde chymotrypsine zelf deelnemen.
in de eerste stap katalyseert trypsine de splitsing van een specifieke peptidebinding, en dit veroorzaakt de activering van chymotrypsinogeen tot π-chymotrypsine, dat volledig actief is. Dan, katalyseert π-chymotrypsin zelf de versie van twee dipeptides met vorming van δ-chymotrypsin, een stabielere vorm van het enzym. δ-chymotrypsine ondergaat twee conformationele veranderingen, waarvan de eerste leidt tot de vorming van de κ-chymotrypsine, en de tweede van α-chymotrypsine, de uiteindelijke actieve vorm van het enzym.
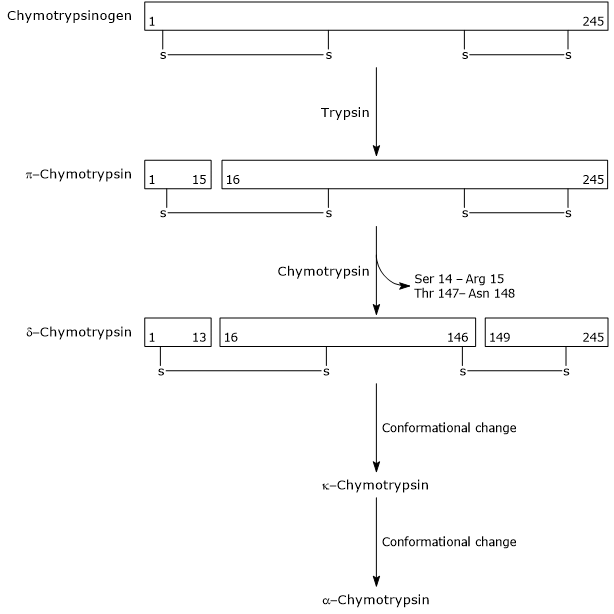
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
Elastase, dat minder specifiek is dan de andere digestieve hydrolasen, katalyseert de splitsing van peptidebindingen naast aminozuren zoals glycine, alanine en serine. - Procarboxypeptidase
Procarboxypeptidase A wordt geactiveerd tot carboxypeptidase a; de protease splijt peptidebindingen naast aminozuren met vertakte of aromatische zijketens, zoals fenylalanine en valine.Procarboxypeptidase B wordt geactiveerd tot carboxypeptidase B, specifiek voor aminozuren met basische zijketens, zoals lysine en arginine.
de bovengenoemde proteasen hebben, in tegenstelling tot pepsine, een optimale pH-werking variërend van 7 tot 8, dat wil zeggen neutraal of zwak alkalisch.
pancreatische trypsineremmer
Er bestaat een “aanvullend” beschermingssysteem tegen intrapancreatische trypsineactiviteit: de synthese van een remmer die “pancreatische trypsineremmer”wordt genoemd. Het molecuul, aanwezig in het pancreas zymogen-granulaat, kan de actieve plaats van het enzym dat het inactiveert zeer strak binden. Op deze manier wordt de activiteit van trypsine als gevolg van een voortijdige activering van trypsinogeen geblokkeerd, waardoor een situatie wordt voorkomen waarin enkele geactiveerde moleculen alle zymogenen in de alvleesklier activeren.in planten zijn er veel moleculen met een vergelijkbare activiteit. Een voorbeeld is de Kunitz trypsine inhibitor, een eiwit dat voornamelijk voorkomt in sojabonen, dat een zeer stabiel complex vormt met de actieve plaats van trypsine.
aangezien de bovengenoemde proteasen een duidelijke substraatspecificiteit hebben en inwerken op peptidebindingen naast verschillende aminozuren, kan elk peptide dat door een protease wordt gegenereerd substraat zijn van een ander. Op deze manier worden de gedeeltelijk verteerde eiwitten die de twaalfvingerige darm binnendringen efficiënt gehydrolyseerd tot vrije aminozuren en peptiden van 2-8 residuen. Deze peptiden zijn substraten van aminopeptidasen die worden uitgescheiden uit enterocyten en geassocieerd met hun microvilli.
Dipeptidase zijn ook aanwezig.
opgemerkt moet worden dat dezelfde proteasen uiteindelijk verteerd worden, waardoor het proces beëindigd wordt.het belang en de effectiviteit van proteolytische enzymen in de spijsvertering van intestinale eiwitten kan worden begrepen uit dit voorbeeld. Als u in vitro een eiwit in de samenstellende aminozuren wilt hydrolyseren, is het noodzakelijk om een sterk en geconcentreerd zuur als katalysator te gebruiken en het monster ‘ s nachts bij 105 ° C Te verwarmen. In de darm wordt hetzelfde resultaat verkregen in een kwestie van uren, eerst werkend in de relatief zure omgeving van de maag, en vervolgens in de milde alkalische omstandigheden van de twaalfvingerige darm, bij 37 °C.de vrijgekomen aminozuren worden samen met di – en tripeptiden door enterocyten geabsorbeerd. De di-en tri-peptiden worden gewoonlijk gehydrolyseerd tot samenstellende aminozuren binnen de enterocyten, en dit verklaart waarom praktisch slechts vrije aminozuren in de portale omloop aanwezig zijn.
Bender D. A. Benders ‘ dictionary of nutrition and food technology. 8e editie. Woodhead Publishing. Oxford, 2006
Bender D. A. Introduction to nutrition and metabolism. 3e editie. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L., and Stryer L. Biochemie. 5e editie. W. H. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. Essentials of medical biochemistry: with clinical cases. 4e editie. Academic Press, 2015
Cozzani I. en Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Principes van de biochemie. 4e editie. W. H. Freeman and Company, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M. D., Glew R. H. Medical Biochemistry: human metabolism in health and disease. John Wiley & Sons, INC., Publication, 2009
Stipanuk M. H., Caudill M. A. Biochemical, physiological, and molecular aspects of human nutrition. 3e editie. Elsevier health sciences, 2013
- maag-en eiwitvertering