8.3: orbitalny Magnetyczny Moment dipolowy elektronu
cele nauki
pod koniec tej sekcji będziesz w stanie:
- wyjaśnij, dlaczego atom wodoru ma właściwości magnetyczne
- wyjaśnij, dlaczego poziomy energii atomu wodoru związane z orbitalnym momentem kątowym są dzielone przez zewnętrzne pole magnetyczne
- użyj liczb kwantowych do obliczenia wielkości i kierunku orbitalnego magnetycznego momentu dipolowego atomu wodoru
w modelu Bohra atomu wodoru elektron porusza się po kołowej orbicie wokół protonu. Elektron przechodzi przez określony punkt na pętli w określonym czasie, więc możemy obliczyć prąd \(I = Q / t\). Elektron, który okrąża proton w atomie wodoru, jest zatem analogiczny do prądu płynącego przez okrągły drut (rysunek \(\PageIndex{1}\)). W badaniach nad magnetyzmem widzieliśmy, że przewód przewodzący prąd wytwarza pole magnetyczne. W związku z tym uzasadnione jest stwierdzenie, że atom wodoru wytwarza pole magnetyczne i oddziałuje z innymi polami magnetycznymi.
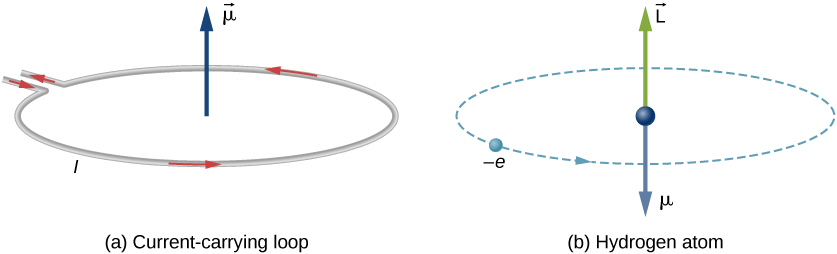
orbitalny magnetyczny moment dipolowy jest miarą siły pola magnetycznego wytwarzanego przez orbitalny moment kątowy elektronu. Z siły i momentu obrotowego na Pętli Prądowej wynika, że wielkość orbitalnego magnetycznego momentu dipolowego dla pętli prądowej wynosi
\
gdzie \(I\) jest prądem, a \(a\) jest obszarem pętli. (Dla zwięzłości nazywamy to momentem magnetycznym.) Prąd \(I\) związany z elektronem na orbicie wokół protonu w atomie wodoru jest
\
gdzie e jest wielkością ładunku elektronu, a \(T\) jest jego okresem orbitalnym. Jeśli założymy, że elektron porusza się po idealnie kołowej orbicie, okres orbitalny wynosi
\
gdzie R jest promieniem orbity, a v jest prędkością elektronu na jej orbicie. Biorąc pod uwagę, że pole okręgu wynosi \(\pi R^2\), absolutny moment magnetyczny to
\
pomocne jest wyrażenie momentu magnetycznego μμ w kategoriach orbitalnego momentu kątowego (\(\vec{L} = \vec{r} \times \vec{p}\)). Ponieważ elektron orbituje w okręgu, wektor położenia \(\vec{r}\) i Wektor pędu \(\vec{p}\) tworzą kąt prosty. Tak więc wielkość orbitalnego momentu pędu wynosi
\
łącząc te dwa równania, mamy
\
w pełnej postaci wektorowej, wyrażenie to zapisuje się jako
\
znak ujemny pojawia się, ponieważ elektron ma ładunek ujemny. Zauważ, że kierunek momentu magnetycznego elektronu jest antyrównoległy do orbitalnego momentu pędu, jak pokazano na rysunku \(\PageIndex{1B}\). W modelu Bohra atomu zależność pomiędzy \(\vec {\mu}\) i \(\vec{L}\) w równaniu \ref{BIG} jest niezależna od promienia orbity.
moment magnetyczny \(μ\) można również wyrazić w kategoriach orbitalnej kątowej liczby kwantowej \(l\). Łącząc równanie \ref{eq2} i równanie \ref{EQ1}, wielkość momentu magnetycznego wynosi
\
z-składowa momentu magnetycznego wynosi
\ &= – \left(\dfrac{e}{2m_e}\right) \, m \hbar \\ &= – \Mu_b m. \label{EQ6} \end{align}\]
ilość \(\Mu_b\) jest podstawową jednostką magnetyzmu zwaną magnesem Bohra, która ma wartość \(9.3 \razy 10^{-24} \, Joule/Tesla\) (J/T) lub \(5.8 \razy 10^{-5} EV/t\). Kwantyzacja momentu magnetycznego jest wynikiem kwantyzacji orbitalnego momentu pędu.
jak zobaczymy w następnej sekcji, całkowity magnetyczny moment dipolowy atomu wodoru wynika zarówno z ruchu orbitalnego elektronu, jak i jego wewnętrznego spinu. Na razie ignorujemy efekt spinu elektronów.
przykład \(\PageIndex{1}\): orbitalny Magnetyczny Moment dipolowy
jaka jest wielkość orbitalnego magnetycznego momentu dipolowego μ elektronu w atomie wodoru w stanie (A) s, (B) P I (C) D? (Załóżmy, że spin elektronu jest zerowy.)
strategia
magnetyczny pęd elektronu jest związany z jego orbitalnym momentem kątowym L. dla atomu wodoru wielkość ta jest związana z orbitalną kątową liczbą kwantową L. Stany są podane w notacji spektroskopowej, która odnosi się do litery (s, p, d itp. ) do liczby kwantowej.
rozwiązanie
wielkość momentu magnetycznego jest podana w równaniu \ref{EQ5}:
\ &= \left(\dfrac{e}{2m_e}\right) \, \sqrt{l(l + 1)} \hbar \nonumber \\ &= \mu_b\sqrt{l(l + 1)}. \end{align}\]
- dla stanu s, \(l = 0\) mamy więc \(\mu = 0\) i \(\mu_z = 0\).
- dla stanu p, \(L = 0\) i mamy \ \gdzie \ (m = (-1, 0, 1)\) więc \
- dla stanu d, \(l = 2\) i otrzymujemy \ \gdzie \ (m = (-2, -1, 0, 1, 2)\) więc \
Znaczenie
w stanie s nie ma orbitalnego momentu kątowego, a zatem nie ma momentu magnetycznego. Nie oznacza to, że elektron jest w spoczynku, tylko, że ogólny ruch elektronu nie wytwarza pola magnetycznego. W stanie p elektron ma moment magnetyczny z trzema możliwymi wartościami dla składowej z tego momentu magnetycznego; oznacza to, że moment magnetyczny może wskazywać w trzech różnych kierunkach biegunowych – każdy jest antyrównoległy do orbitalnego wektora momentu pędu. W stanie d elektron ma moment magnetyczny z pięcioma możliwymi wartościami dla składowej z tego momentu magnetycznego. W tym przypadku moment magnetyczny może wskazywać w pięciu różnych kierunkach biegunowych.
atom wodoru ma pole magnetyczne, więc spodziewamy się, że atom wodoru oddziałuje z zewnętrznym polem magnetycznym—takim jak pchanie i ciągnięcie między dwoma magnesami prętowymi. Z siły i momentu obrotowego na Pętli Prądowej wiemy, że kiedy Pętla Prądowa oddziałuje z zewnętrznym polem magnetycznym \(\vec{B}\), doświadcza momentu obrotowego podanego przez
\
gdzie I jest prądem, \(\vec{a}\) jest obszarem pętli, \(\vec{\mu}\) jest momentem magnetycznym, a \(\vec{B}\) jest zewnętrznym polem magnetycznym. Ten moment obrotowy działa, aby obrócić wektor momentu magnetycznego atomu wodoru w celu wyrównania z zewnętrznym polem magnetycznym. Ponieważ praca mechaniczna jest wykonywana przez zewnętrzne pole magnetyczne na atomie wodoru, możemy mówić o przemianach energii w atomie. Energia potencjalna atomu wodoru związana z tą interakcją magnetyczną jest dana równaniem \ ref{eq30}:
\
Jeśli moment magnetyczny jest antyrównoległy do zewnętrznego pola magnetycznego, energia potencjalna jest duża, ale jeśli moment magnetyczny jest równoległy do pola, energia potencjalna jest mała. Praca nad atomem wodoru w celu obrócenia wektora momentu magnetycznego atomu w kierunku zewnętrznego pola magnetycznego jest zatem związana ze spadkiem energii potencjalnej. Energia układu jest jednak zachowana, ponieważ spadek energii potencjalnej wytwarza promieniowanie (emisja fotonu). Te przejścia energetyczne są kwantyzowane, ponieważ moment magnetyczny może wskazywać tylko w określonych kierunkach.
Jeśli zewnętrzne pole magnetyczne wskazuje dodatni kierunek z, energia potencjalna związana z orbitalnym magnetycznym momentem dipolowym wynosi
\
gdzie \(\mu_B\) jest magnesem Bohra, A m jest liczbą kwantową rzutu momentu pędu (lub magnetyczną orbitalną liczbą kwantową), która ma wartości
\
na przykład w stanie elektronu \(L = 1\) całkowita energia elektronu jest podzielona na trzy różne poziomy energetyczne odpowiadający \(u = -\mu_b B, 0, \mu_b B\).
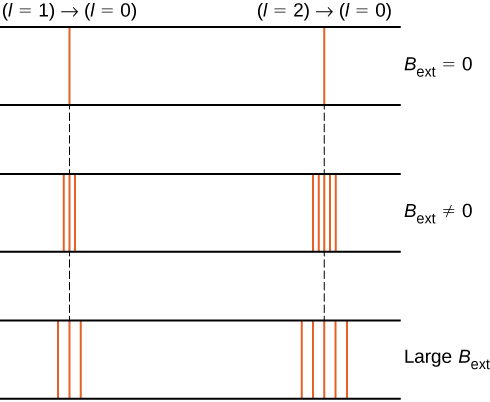
podział poziomów energii przez zewnętrzne pole magnetyczne nazywany jest efektem Zeemana. Ignorując skutki spinu elektronów, przejścia ze stanu \(L = 1\) do wspólnego stanu energii niższej tworzą trzy ściśle rozmieszczone linie spektralne (rysunek \(\PageIndex{2}\), lewa kolumna). Podobnie przejścia ze stanu \(l = 2\) wytwarzają pięć ściśle rozmieszczonych linii widmowych (prawa kolumna). Rozdzielenie tych linii jest proporcjonalne do siły zewnętrznego pola magnetycznego. Efekt ten ma wiele zastosowań. Na przykład, podział linii w widmie wodorowym słońca jest używany do określenia siły pola magnetycznego słońca. Wiele takich pomiarów pola magnetycznego można wykorzystać do sporządzenia mapy aktywności magnetycznej na powierzchni Słońca zwanej magnetogramem (rysunek \(\PageIndex{3}\)).

autorzy i atrybuty
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) i Bill Moebs z wieloma współautorami. Ta praca jest licencjonowana przez OpenStax University Physics na licencji Creative Commons Attribution License (by 4.0).