Proteinverdauung: Schritte, Enzyme und Hormone
Der Körper benötigt Proteine und insbesondere die darin enthaltenen essentiellen Aminosäuren. Die empfohlene Tagesdosis für ein gesundes erwachsenes Subjekt beträgt 0,85 g / kg Körpergewicht, also für eine 70 kg Person etwa 60 g, aber oft in der typischen westlichen Ernährung ist die Aufnahme größer als 100 g / Tag.
Zusätzlich zu Nahrungsproteinen verdaut der Körper auch 50-100 g endogene Proteine, die in das Lumen des Gastrointestinaltrakts sezerniert oder verloren gehen und die resultieren aus:
- Speichel;
- Magensaft;
- Pankreasenzyme und andere Sekrete;
- Darmzellen, die abblättern;
- Proteine, die aus dem Blutkreislauf in das Darmlumen gelangen.
Diese Mischung wird effizient im Zwölffingerdarm, dem ersten und kürzesten Teil des Dünndarms, verdaut und absorbiert, wobei der tägliche Verlust durch Fäkalien etwa 1,6 g Stickstoff entspricht, was 10 g Protein entspricht. Der größte Teil des verlorenen Stickstoffs wird von der Mikroflora im Dickdarm für sein Wachstum verwendet und befindet sich daher im Kot als Teil der Bakterienmasse.
INHALT
- Verdauungsenzyme
- Rolle des Kochens und Kauens von Lebensmitteln
- Stadien der Proteinverdauung
- Magen- und Proteinverdauung
- Proteinverdauung und Pepsin
- Zwölffingerdarm- und Proteinverdauung
- Aktivierung von Pankreaszymogenen
- Pankreas-Trypsin-Inhibitor
- Magen- und Proteinverdauung
Verdauungsenzyme
Die Proteinverdauung erfolgt als Ergebnis der Hydrolyse der Peptidbindungen, die die einzelnen Aminosäuren in der Polypeptidkette binden. Diese Reaktionen werden durch Enzyme katalysiert, die Proteasen genannt werden.
Die für die Aminosäureseitenkette spezifischen Darmproteasen sind Hydrolasen, die in zwei Klassen eingeteilt werden können:
- Endopeptidasen, die Peptidbindungen innerhalb der Polypeptidkette hydrolysieren und vom Magen und der exokrinen Bauchspeicheldrüse produziert werden;
- Exopeptidasen, die in zwei Gruppen eingeteilt werden können:
die Carboxypeptidase, die Aminosäuren vom C-terminalen Ende entfernt und von der Leber produziert wird das exokrine Pankreas;
die Aminopeptidase, die am N-terminalen Ende wirken und von den Enterozyten produziert werden.

Diese Enzyme werden in einer inaktiven Form synthetisiert und sezerniert, die als Zymogene oder Proenzyme bezeichnet wird.
Innerhalb der Zelle werden Zymogene in membrangebundenen Granulaten gespeichert, die als Zymogengranulate bezeichnet werden. Wenn die Zelle durch das spezifische Signal stimuliert wird, verschmilzt die Granulatmembran mit der Plasmamembran und Zymogene werden durch Exozytose freigesetzt.
Diese Proteasen werden in inaktiver Form synthetisiert, um zu vermeiden, dass sie sich selbst und / oder Gewebeproteine verdauen, bevor sie ausgeschieden werden. Was passiert, ist, dass das aktive Zentrum des Enzyms „maskiert“ ist und erst nach Aktivierung das Protein auf das Substrat einwirken kann. Die Aktivierung ist das Ergebnis der durch ein spezifisches Enzym katalysierten Spaltung einer oder mehrerer spezifischer Peptidbindungen unter Freisetzung eines oder mehrerer Segmente der Polypeptidkette. Dadurch kann das Molekül eine dreidimensionale Konformation annehmen, in der das aktive Zentrum frei und richtig konfiguriert ist.
Sogar ihre Akkumulation innerhalb des Granulats ist ein Schutzsystem: Es isoliert sie von den anderen in der Zelle vorhandenen Molekülen.
Die meisten Proteine in ihrer nativen Konformation sind resistent gegen die Wirkung von Proteasen. Dies ist eine Folge ihrer sekundären und tertiären oder nativen Struktur, die viele Bindungen an die Wirkung der Enzyme maskieren. Diese Strukturen werden durch kovalente Bindungen, wie Disulfidbrücken zwischen Cysteinresten, und nicht-kovalente Kräfte, wie ionische Wechselwirkungen, Wasserstoffbrücken und Van-der-Waals-Kräfte, stabilisiert.
Für eine adäquate Proteinverdauung ist es daher essentiell, dass Peptidbindungen der Wirkung der Darmproteasen möglichst zugänglich sind. Dies wird außerhalb des Körpers durch das Kochen von Lebensmitteln und innerhalb des Körpers durch die saure Umgebung im Magen erreicht.
Rolle des Kochens und Kauens von Lebensmitteln
Das Kochen von Lebensmitteln, wenn es nicht übermäßig ist, erleichtert die Proteinverdauung.
Auf welche Weise?Wie alle Moleküle sind auch Proteine nicht bewegungslos, sondern vibrieren. Mit zunehmender Temperatur vibrieren die Proteine mit größerer Amplitude, um die nichtkovalenten Bindungen zu zerstören, die zur Aufrechterhaltung der nativen Struktur beitragen. Daher tritt eine Konformationsänderung des Proteins auf, dh das Molekül wird denaturiert. Dies kann interne Peptidbindungen für die Wirkung von Verdauungsenzymen zugänglicher machen.
Auch das Kauen und insalivation von Lebensmitteln homogenisieren und befeuchten die festen Bestandteile der Nahrung selbst, die Magen- und Dünndarmverdauung zu erleichtern.
Stadien der Proteinverdauung
Zwei Stadien sind an der Verdauung von Proteinen beteiligt: die erste tritt im Magen und die andere im Zwölffingerdarm, dem ersten Teil des Dünndarms, auf.
Magen- und Proteinverdauung
Die Proteinverdauung beginnt im Magen, und dies ist eine „Vorbereitungsphase“ im Vergleich zu den Ereignissen, die im Zwölffingerdarm auftreten.
Das Vorhandensein von Nahrung im Magen stimuliert die Zellen der Schleimhaut des Magenantrums und des proximalen Zwölffingerdarms, um das Hormon Gastrin zu produzieren und in den Blutkreislauf freizusetzen. Das Hormon stimuliert die Belegzellen der richtigen Magendrüsen, die hauptsächlich am Boden des Organs lokalisiert sind, um Salzsäure zu produzieren und in den Magen abzuscheiden (Belegzellen produzieren auch den intrinsischen Faktor, ein Protein, das Vitamin B12 bindet, dessen Zerstörung verhindert und dessen Absorption ermöglicht).
In den richtigen Magendrüsen fanden Sie auch:
- Schleimhalszellen, die Schleim produzieren;
- Schleimzellen, die Pepsinogen freisetzen.
Alle diese Substanzen sind zusammen mit anderen wie Kaliumionen und der Magenlipase im Magensaft vorhanden, der einen pH-Wert zwischen 1 und 2,5 aufweist.
Aufgrund seines niedrigen pH-Wertes hat der Magensaft eine antiseptische Wirkung, die die meisten Bakterien und andere fremde Zellen abtötet, und eine denaturierende Wirkung, da er die nichtkovalenten Bindungen aufbricht, die die native Struktur von Proteinen aufrechterhalten. Dieser denaturierende Effekt erleichtert den Zugang der Darmprotease zu Peptidbindungen, wie das Erhitzen während des Kochens. Einige Proteine, die reich an Disulfidbindungen sind, wie Keratine, sind resistent gegen Denaturierung durch niedrigen pH-Wert und daher schwer verdaulich. Im Gegenteil, die meisten globulären Proteine werden fast vollständig zu Aminosäuren hydrolysiert.Schließlich aktiviert der niedrige pH-Wert des Magensaftes Pepsinogen, ein Zymogen, zu Pepsin, dem ersten Enzym, das an der Proteinverdauung beteiligt ist.
Proteinverdauung und Pepsin
Es gibt verschiedene Isoenzyme von Pepsinogen, wie Typ I, synthetisiert von den Zellen des Körpers und Fundus des Magens, und Typ II, der in allen Regionen des Organs produziert wird. Alle Isoenzyme werden in das aktive Enzym umgewandelt. Die Aktivierung erfolgt durch Autokatalyse bei pH-Werten unter 5 durch einen intramolekularen Prozess, der in der Hydrolyse einer spezifischen Peptidbindung und Freisetzung eines kleinen Peptids vom N-terminalen Ende des Proenzyms besteht. Dieses Peptid bleibt an das Enzym gebunden und wirkt weiterhin als Inhibitor, bis der pH-Wert unter 2 fällt oder bis es durch Pepsin selbst weiter abgebaut wird. Sobald also etwas Pepsin gebildet wird, aktiviert dies schnell andere Pepsinogenmoleküle.Pepsin, eine Endopeptidase mit einem optimalen pH-Wert von 1,6, hydrolysiert 10-20% der Proteine in der Mahlzeit. Viele Verdauungsenzyme können auf eine Vielzahl von Substraten einwirken, und Pepsin ist keine Ausnahme und katalysiert die Spaltung von Peptidbindungen neben Aminosäureresten wie Leucin und Phenylalanin, Tyrosin und Tryptophan (aromatische Aminosäuren). Eine Mischung aus Peptiden großer Größe und einigen freien Aminosäuren wird hergestellt.Die Wirkung von Pepsin ist nicht so sehr für seinen direkten Beitrag zur Proteinverdauung wichtig, sondern für die Freisetzung von Peptiden und Aminosäuren, die auf Zwölffingerdarmebene die Sekretion von Cholecystokinin und damit die Zwölffingerdarm- / Pankreasphase der Proteinverdauung stimulieren (siehe unten).Es sollte beachtet werden, dass die Wirkung von Pepsin auf Kollagen, eine Familie von Proteinen, die die Muskelzellen umhüllen und zusammenhalten, den Zugang der Pankreasprotease zu den Proteinen erleichtert.
Zwölffingerdarm und Proteinverdauung
Wenn der Mageninhalt in den Zwölffingerdarm gelangt, stimuliert seine Säure S-Zellen, die in der Zwölffingerdarmschleimhaut und im proximalen Teil des Jejunums (dem nächsten Teil des Dünndarms) lokalisiert sind, um das Hormon Sekretin zu produzieren und in den Blutkreislauf freizusetzen. Das Hormon bewirkt die Sekretion eines alkalischen Pankreassaftes, der reich an Bicarbonationen, aber arm an Enzymen ist und durch den Pankreasgang in den Zwölffingerdarm gelangt. Im Zwölffingerdarm neutralisiert es die vom Magen produzierte Salzsäure und erhöht den pH-Wert auf etwa 7 (neutrale Werte). Sekretin stimuliert auch die Gallensekretion und reduziert die Freisetzung von Gastrin.Das Vorhandensein von Aminosäuren im Zwölffingerdarm stimuliert, wie oben erwähnt, endokrine Zellen im Zwölffingerdarm und Jejunum, Cholecystokinin (CKK) zu produzieren und in den Blutkreislauf freizusetzen. Das Hormon stimuliert unter anderem die exokrine Bauchspeicheldrüse, einen Saft abzusondern, der reich an Enzymen ist (vorhanden als Zymogene), dh:
- Trypsinogen, Chymotrypsinogen und Proelastase, Endopeptidasen mit einer anderen Substratspezifität als Pepsin, aber auch darunter;
- Procarboxypeptidase A und B, Exopeptidasen, die Aminosäuren vom C-terminalen Ende der Peptide entfernen.
Daher gibt es im Zwölffingerdarm eine neutrale Umgebung, die reich an Enzymen ist, die nach der Aktivierung die Proteinverdauung fortsetzen können. Da die Proteasen außerdem eine unterschiedliche Substratspezifität aufweisen, kann jedes von einem Enzym produzierte Peptid Substrat eines anderen Enzyms sein.
Im Pankreassaft sind auch Amylase, Lipase und Nuklease vorhanden.
Aktivierung von Pankreaszymogenen
Der erste und wichtigste Schritt bei ihrer Aktivierung ist die Umwandlung von Trypsinogen in Trypsin durch Enteropeptidase (auch Enterokinase genannt), eine Endopeptidase, die von Zellen des Zwölffingerdarms nach Cholecystokininstimulation produziert wird. Enteropeptidase katalysiert die Spaltung einer spezifischen Peptidbindung zwischen einem Lysinrest und einem Isoleucinrest des Trypsinogens unter Freisetzung eines Hexapeptids. Dies bewirkt eine Konformationsumlagerung des Proteins, das es aktiviert, dh Trypsin wird gebildet.
Das Enzym spaltet Peptidbindungen neben Lysin und Arginin Reste von Protein zu verdauen; darüber hinaus kann es aktivieren Chymotrypsinogen, Proelastase und Procarboxypeptidase A und B, sondern auch andere Moleküle von Trypsinogen, wie Pepsin (Autokatalyse).
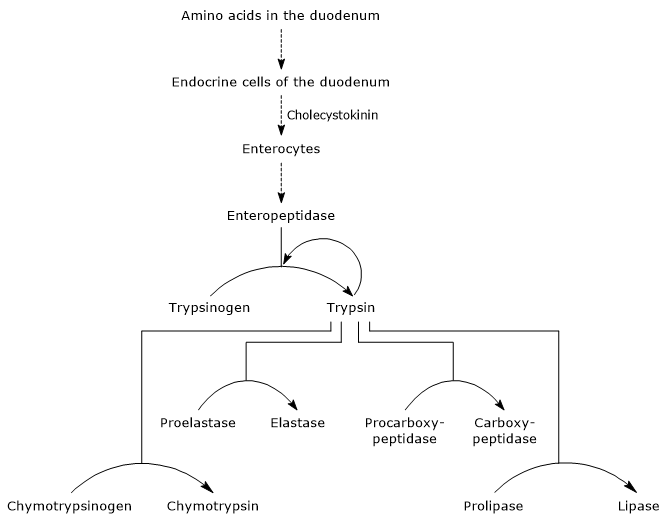
Daher nimmt die Fähigkeit des Zwölffingerdarms, Proteine zu verdauen, zu, wenn die Pankreaszymogene aktiviert werden, die alle durch eine kleine Menge Enteropeptidase ausgelöst werden.
- Die Aktivierung von Chymotrypsinogen zu Chymotrypsin erfolgt durch verschiedene Schritte, an denen Trypsin und das aktivierte Chymotrypsin selbst beteiligt sind.
Im ersten Schritt katalysiert Trypsin die Spaltung einer spezifischen Peptidbindung, und dies bewirkt die Aktivierung von Chymotrypsinogen zu π-Chymotrypsin, das vollständig aktiv ist. Dann katalysiert π-Chymotrypsin selbst die Freisetzung von zwei Dipeptiden unter Bildung des δ-Chymotrypsins, einer stabileren Form des Enzyms. δ-Chymotrypsin erfährt zwei Konformationsänderungen, von denen die erste zur Bildung des κ-Chymotrypsins und die zweite von α-Chymotrypsin, der endgültigen aktiven Form des Enzyms, führt.
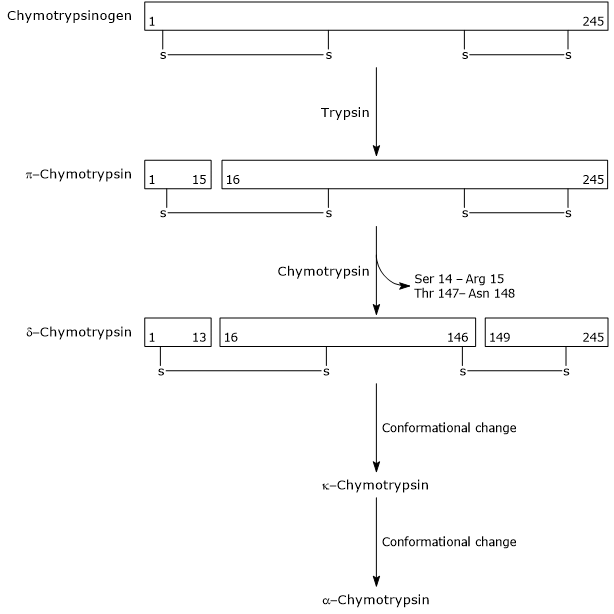
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
Elastase, die weniger spezifisch als die anderen Verdauungshydrolasen ist, katalysiert die Spaltung von Peptidbindungen neben Aminosäuren wie Glycin, Alanin und Serin. - Procarboxypeptidase
Procarboxypeptidase A wird zu Carboxypeptidase A aktiviert; Die Protease spaltet Peptidbindungen neben Aminosäuren mit verzweigten oder aromatischen Seitenketten wie Phenylalanin und Valin.
Procarboxypeptidase B wird zu Carboxypeptidase B aktiviert, die spezifisch für Aminosäuren mit basischen Seitenketten wie Lysin und Arginin ist.
Die oben genannten Proteasen haben im Gegensatz zu Pepsin einen optimalen pH-Wert im Bereich von7 bis 8, dh neutral oder schwach alkalisch.
Pankreas-Trypsin-Inhibitor
Es gibt ein „zusätzliches“ Schutzsystem gegen intrapankreatische Trypsinaktivität: die Synthese eines Inhibitors namens „Pankreas-Trypsin-Inhibitor“. Das Molekül, das in den pankreatischen Zymogengranulaten vorhanden ist, ist in der Lage, das aktive Zentrum des Enzyms, das es inaktiviert, sehr fest zu binden. Auf diese Weise wird die Aktivität eines Trypsins, das aus einer vorzeitigen Aktivierung von Trypsinogen resultiert, blockiert, wodurch eine Situation verhindert wird, in der einige wenige aktivierte Moleküle alle Pankreaszymogene aktivieren.
In Pflanzen gibt es viele Moleküle mit ähnlicher Aktivität. Ein Beispiel ist der Kunitz-Trypsin-Inhibitor, ein Protein, das hauptsächlich in Sojabohnen vorkommt und mit dem aktiven Zentrum von Trypsin einen sehr stabilen Komplex bildet.
Da die oben genannten Proteasen eine ausgeprägte Substratspezifität aufweisen, die auf Peptidbindungen wirkt, die an verschiedene Aminosäuren angrenzen, kann jedes Peptid, das von einer Protease erzeugt wird, Substrat eines anderen sein. Auf diese Weise werden die teilweise verdauten Proteine, die in den Zwölffingerdarm gelangen, effizient zu freien Aminosäuren und Peptiden von 2-8 Resten hydrolysiert. Diese Peptide sind Substrate von Aminopeptidasen, die aus Enterozyten sezerniert und mit ihren Mikrovilli assoziiert sind.
Dipeptidase sind ebenfalls vorhanden.
Es sollte beachtet werden, dass die gleichen Proteasen schließlich verdaut werden und den Prozess beenden.
Die Bedeutung und Wirksamkeit von proteolytischen Enzymen in der intestinalen Proteinverdauung kann aus diesem Beispiel verstanden werden. Wenn Sie in vitro ein Protein in seine Aminosäuren hydrolysieren möchten, ist es notwendig, eine starke und konzentrierte Säure als Katalysator zu verwenden und die Probe über Nacht auf 105 ° C zu erhitzen. Im Darm wird das gleiche Ergebnis in wenigen Stunden erhalten, zuerst in der relativ sauren Umgebung des Magens und dann in den milden alkalischen Bedingungen des Zwölffingerdarms bei 37 ° C.
Die freigesetzten Aminosäuren werden zusammen mit Di- und Tripeptiden von Enterozyten absorbiert. Die Di- und Tripeptide werden üblicherweise innerhalb der Enterozyten zu konstituierenden Aminosäuren hydrolysiert, was erklärt, warum praktisch nur freie Aminosäuren im Portalkreislauf vorhanden sind.
Bender D.A. Benders‘ Wörterbuch der Ernährung und Lebensmitteltechnologie. 8. Auflage. In: Woodhead Publishing. Oxford, 2006
Bender D.A. Einführung in Ernährung und Stoffwechsel. 3. Auflage. Taylor & Francis, 2004
Berg J.M., Tymoczko J.L. und Stryer L. Biochemie. 5. Auflage. W. H. Freeman and Company, 2002
Bhagavan N.V., Ha C-E. Grundlagen der medizinischen Biochemie: mit klinischen Fällen. 4. Auflage. Academic Press, 2015
Cozzani I. und Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D.L., Cox M.M. Lehninger. Prinzipien der Biochemie. 4. Auflage. W.H. Freeman und Unternehmen, 2004
Rawn JD Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medizinische Biochemie: Menschlicher Stoffwechsel bei Gesundheit und Krankheit. John Wiley & Sons, INC., Publication, 2009
Stipanuk M.H., Caudill M.A. Biochemische, physiologische und molekulare Aspekte der menschlichen Ernährung. 3. Auflage. Elsevier health sciences, 2013