7.1: Molécules organiques
Molécules organiques et isomérie
Les molécules organiques des organismes sont généralement plus grandes et plus complexes que les molécules inorganiques. Leurs squelettes carbonés sont maintenus ensemble par des liaisons covalentes. Ils forment les cellules d’un organisme et effectuent les réactions chimiques qui facilitent la vie. Toutes ces molécules, appelées biomolécules parce qu’elles font partie de la matière vivante, contiennent du carbone, qui est la pierre angulaire de la vie. Le carbone est un élément tout à fait unique en ce sens qu’il a quatre électrons de valence dans ses orbitales extérieures et peut former quatre liaisons covalentes simples avec jusqu’à quatre autres atomes en même temps (voir l’annexe A). Ces atomes sont généralement l’oxygène, l’hydrogène, l’azote, le soufre, le phosphore et le carbone lui-même; le composé organique le plus simple est le méthane, dans lequel le carbone ne se lie qu’à l’hydrogène (Figure \(\PageIndex{2}\)).
Grâce à la combinaison unique de la taille et des propriétés de liaison du carbone, les atomes de carbone peuvent se lier en grand nombre, produisant ainsi une chaîne ou un squelette carboné. Le squelette carboné des molécules organiques peut être droit, ramifié ou en forme d’anneau (cyclique). Les molécules organiques sont construites sur des chaînes d’atomes de carbone de longueurs variables; la plupart sont généralement très longues, ce qui permet un grand nombre et une grande variété de composés. Aucun autre élément n’a la capacité de former autant de molécules différentes de tant de tailles et de formes différentes.
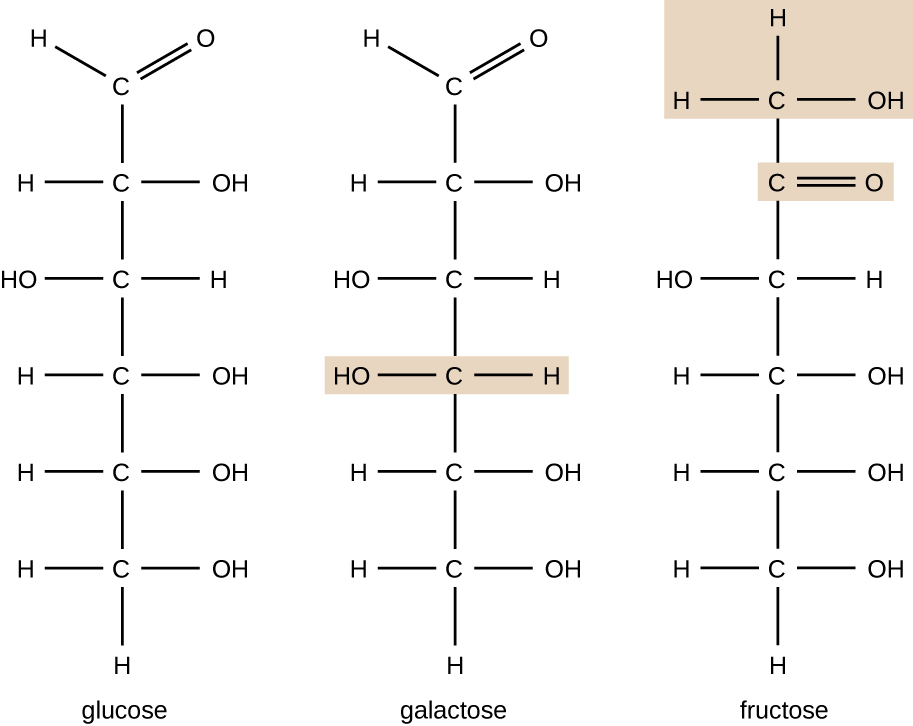
Les molécules ayant la même composition atomique mais une disposition structurelle différente des atomes sont appelées isomères. Le concept d’isomérie est très important en chimie car la structure d’une molécule est toujours directement liée à sa fonction. De légères modifications de la structure des atomes dans une molécule peuvent conduire à des propriétés très différentes. Les chimistes représentent les molécules par leur formule structurelle, qui est une représentation graphique de la structure moléculaire, montrant comment les atomes sont disposés. Les composés qui ont des formules moléculaires identiques mais qui diffèrent par la séquence de liaison des atomes sont appelés isomères structurels. Les monosaccharides glucose, galactose et fructose ont tous la même formule moléculaire, C6H12O6, mais nous pouvons voir sur la figure \(\PageIndex{3}\) que les atomes sont liés différemment.
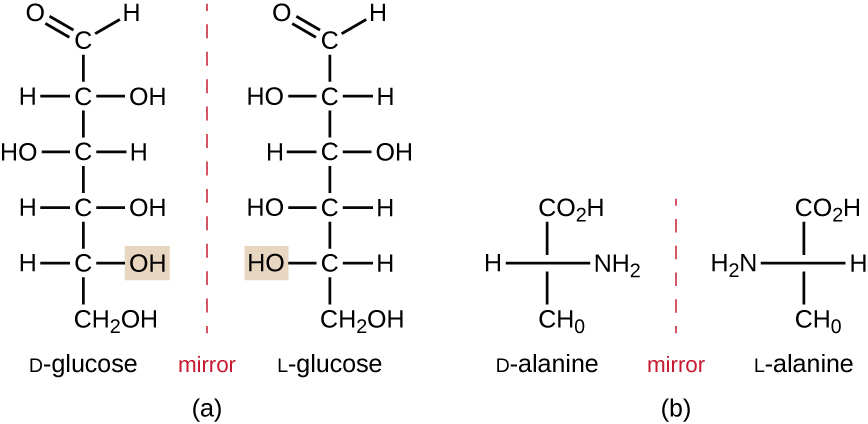
Les isomères qui diffèrent dans les arrangements spatiaux des atomes sont appelés stéréoisomères; un type unique est les énantiomères. Les propriétés des énantiomères ont été découvertes à l’origine par Louis Pasteur en 1848 en utilisant un microscope pour analyser les produits de fermentation cristallisés du vin. Les énantiomères sont des molécules qui ont la caractéristique de chiralité, dans lesquelles leurs structures sont des images miroir non superposables les unes des autres. La chiralité est une caractéristique importante dans de nombreuses molécules d’importance biologique, comme l’illustrent les exemples de différences structurelles dans les formes énantiomères du monosaccharide glucose ou de l’acide aminé alanine (Figure \(\PageIndex{4}\)).
De nombreux organismes ne peuvent utiliser qu’une seule forme énantiomérique de certains types de molécules comme nutriments et comme éléments constitutifs pour créer des structures au sein d’une cellule. Certaines formes énantiomères d’acides aminés ont des goûts et des odeurs nettement différents lorsqu’elles sont consommées comme nourriture. Par exemple, le L-aspartame, communément appelé aspartame, a un goût sucré, tandis que le D-aspartame est insipide. Les énantiomères de médicaments peuvent avoir des effets pharmacologiques très différents. Par exemple, le composé méthorphane existe sous la forme de deux énantiomères, dont l’un agit comme antitussif (dextrométhorphane, un antitussif), tandis que l’autre agit comme analgésique (lévométhorphane, un médicament similaire à la codéine).
Les énantiomères sont également appelés isomères optiques car ils peuvent faire pivoter le plan de la lumière polarisée. Certains des cristaux observés par Pasteur à partir de la fermentation du vin ont tourné la lumière dans le sens des aiguilles d’une montre tandis que d’autres ont tourné la lumière dans le sens inverse des aiguilles d’une montre. Aujourd’hui, nous désignons les énantiomères qui font tourner la lumière polarisée dans le sens horaire (+) sous forme de d, et l’image miroir de la même molécule qui fait tourner la lumière polarisée dans le sens antihoraire (−) sous forme de l. Les étiquettes d et l sont dérivées des mots latins dexter (à droite) et laevus (à gauche), respectivement. Ces deux isomères optiques différents ont souvent des propriétés et des activités biologiques très différentes. Certaines espèces de moisissures, de levures et de bactéries, telles que Rhizopus, Yarrowia et Lactobacillus spp., respectivement, ne peut métaboliser qu’un seul type d’isomère optique; l’isomère opposé ne convient pas comme source de nutriments. Une autre raison importante de connaître les isomères optiques est l’utilisation thérapeutique de ces types de produits chimiques pour le traitement médicamenteux, car certains microorganismes ne peuvent être affectés que par un seul isomère optique spécifique.
Exercice \(\PageIndex{3}\)
Nous disons que la vie est à base de carbone. Qu’est-ce qui rend le carbone si approprié pour faire partie de toutes les macromolécules des organismes vivants?