7.1: organische moleculen
organische moleculen en isomerisme
organische moleculen in organismen zijn over het algemeen groter en complexer dan anorganische moleculen. Hun koolstofskeletten worden bij elkaar gehouden door covalente bindingen. Ze vormen de cellen van een organisme en voeren de chemische reacties uit die het leven vergemakkelijken. Al deze moleculen, biomoleculen genoemd omdat ze deel uitmaken van levende materie, bevatten koolstof, de bouwsteen van het leven. Koolstof is een zeer uniek element omdat het vier valentie-elektronen in zijn buitenste orbitalen heeft en vier enkelvoudige covalente bindingen kan vormen met maximaal vier andere atomen tegelijk (zie Bijlage A). Deze atomen zijn meestal zuurstof, waterstof, stikstof, zwavel, fosfor en koolstof zelf; de eenvoudigste organische verbinding is methaan, waarin koolstof alleen aan waterstof bindt (figuur \(\Paginindex{2}\)).
door de unieke combinatie van grootte en bindingseigenschappen van koolstof kunnen koolstofatomen in grote aantallen aan elkaar binden, waardoor een keten of koolstofskelet ontstaat. Het koolstofskelet van organische moleculen kan recht, vertakt of ringvormig (cyclisch) zijn. Organische moleculen zijn gebouwd op ketens van koolstofatomen van verschillende lengtes; de meeste zijn meestal erg lang, wat een groot aantal en verscheidenheid aan verbindingen mogelijk maakt. Geen enkel ander element heeft de mogelijkheid om zoveel verschillende moleculen van zoveel verschillende grootte en vormen te vormen.
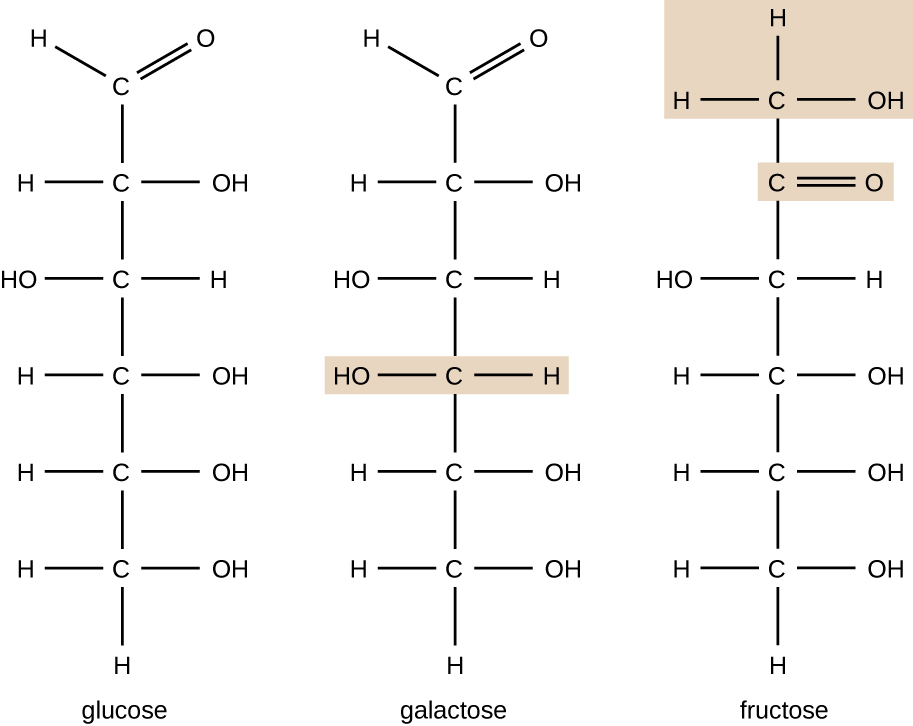
moleculen met dezelfde atomaire samenstelling maar een andere structuurindeling van atomen worden isomeren genoemd. Het concept van isomerisme is zeer belangrijk in de chemie omdat de structuur van een molecuul altijd direct gerelateerd is aan zijn functie. Kleine veranderingen in de structuur van atomen in een molecuul kunnen leiden tot zeer verschillende eigenschappen. Scheikundigen vertegenwoordigen moleculen door hun structuurformule, die een grafische weergave is van de moleculaire structuur, die laat zien hoe de atomen zijn gerangschikt. Verbindingen die identieke moleculaire formules hebben maar verschillen in de bindingsvolgorde van de atomen worden structurele isomeren genoemd. De monosachariden glucose, galactose en fructose hebben allemaal dezelfde moleculaire formule, C6H12O6, maar we kunnen aan Figuur \(\Pagindex{3}\) zien dat de atomen anders aan elkaar zijn gebonden.
isomeren die verschillen in de ruimtelijke ordening van atomen worden stereoisomeren genoemd; een uniek type is enantiomeren. De eigenschappen van enantiomers werden oorspronkelijk ontdekt door Louis Pasteur in 1848 terwijl het gebruiken van een microscoop om gekristalliseerde gistingsproducten van wijn te analyseren. Enantiomers zijn molecules die het kenmerk van chirality hebben, waarin hun structuren niet super imposable spiegelbeelden van elkaar zijn. Chiraliteit is een belangrijk kenmerk in veel biologisch belangrijke moleculen, zoals blijkt uit de voorbeelden van structurele verschillen in de enantiomere vormen van de monosaccharide glucose of het aminozuur alanine (figuur \(\Paginindex{4}\)).
veel organismen kunnen slechts één enantiomere vorm van bepaalde moleculen gebruiken als voedingsstoffen en als bouwstenen om structuren in een cel te maken. Sommige enantiomeric vormen van aminozuren hebben duidelijk verschillende smaken en geuren wanneer geconsumeerd als voedsel. Bijvoorbeeld, l-aspartaam, algemeen genoemd aspartaam, smaakt zoet, terwijl D-aspartaam smaakloos is. Drug enantiomers kunnen zeer verschillende farmacologische gevolgen hebben. De verbinding methorfan bestaat bijvoorbeeld als twee enantiomeren, waarvan er één als antitussief werkt (dextromethorfan, een hoestonderdrukkend middel), terwijl de andere als analgeticum werkt (levomethorfan, een geneesmiddel dat in feite op codeïne lijkt).
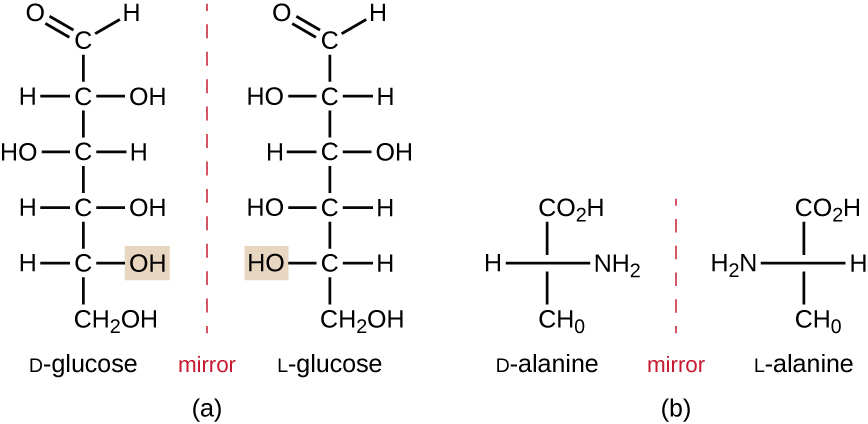
enantiomeren worden ook optische isomeren genoemd omdat ze het vlak van gepolariseerd licht kunnen roteren. Sommige van de kristallen Pasteur waargenomen van wijnfermentatie draaide licht met de klok mee, terwijl anderen draaide het licht tegen de klok in. Vandaag, wijzen wij enantiomers aan die gepolariseerd licht met de klok mee (+) als d vormen roteren, en het spiegelbeeld van dezelfde molecule die gepolariseerd licht tegen de klok in (−) als L vorm roteert. De labels D en l zijn afgeleid van de Latijnse woorden dexter (rechts) en laevus (links), respectievelijk. Deze twee verschillende optische isomeren hebben vaak zeer verschillende biologische eigenschappen en activiteiten. Bepaalde soorten schimmels, gist en bacteriën, zoals Rhizopus, Yarowia en Lactobacillus spp., respectievelijk, kan slechts één type optisch isomeer metaboliseren; het tegenovergestelde isomeer is niet geschikt als bron van voedingsstoffen. Een andere belangrijke reden om van optische isomeren bewust te zijn is het therapeutische gebruik van deze soorten chemische producten voor drugbehandeling, omdat sommige micro-organismen slechts door één specifiek optisch isomeer kunnen worden beà nvloed.
oefening \(\Paginindex{3}\)
we zeggen dat het leven gebaseerd is op koolstof. Wat maakt koolstof zo geschikt om deel uit te maken van alle macromoleculen van levende organismen?