7.1: organiska molekyler
organiska molekyler och Isomerism
organiska molekyler i organismer är i allmänhet större och mer komplexa än oorganiska molekyler. Deras kolskelett hålls samman av kovalenta bindningar. De bildar cellerna i en organism och utför de kemiska reaktionerna som underlättar livet. Alla dessa molekyler, som kallas biomolekyler eftersom de är en del av levande materia, innehåller kol, vilket är livets byggstenar. Kol är ett mycket unikt element genom att det har fyra valenselektroner i sina yttre orbitaler och kan bilda fyra enkla kovalenta bindningar med upp till fyra andra atomer samtidigt (se Bilaga A). Dessa atomer är vanligtvis syre, väte, kväve, svavel, fosfor och kol i sig; den enklaste organiska föreningen är metan, där kol endast binder till väte (figur \(\PageIndex{2}\)).
som ett resultat av KOLS unika kombination av storlek och bindningsegenskaper kan kolatomer binda ihop i stort antal, vilket ger en kedja eller kolskelett. Kolskelettet av organiska molekyler kan vara rakt, grenat eller ringformat (cykliskt). Organiska molekyler är byggda på kedjor av kolatomer av varierande längder; de flesta är vanligtvis mycket långa, vilket möjliggör ett stort antal och olika föreningar. Inget annat element har förmågan att bilda så många olika molekyler av så många olika storlekar och former.
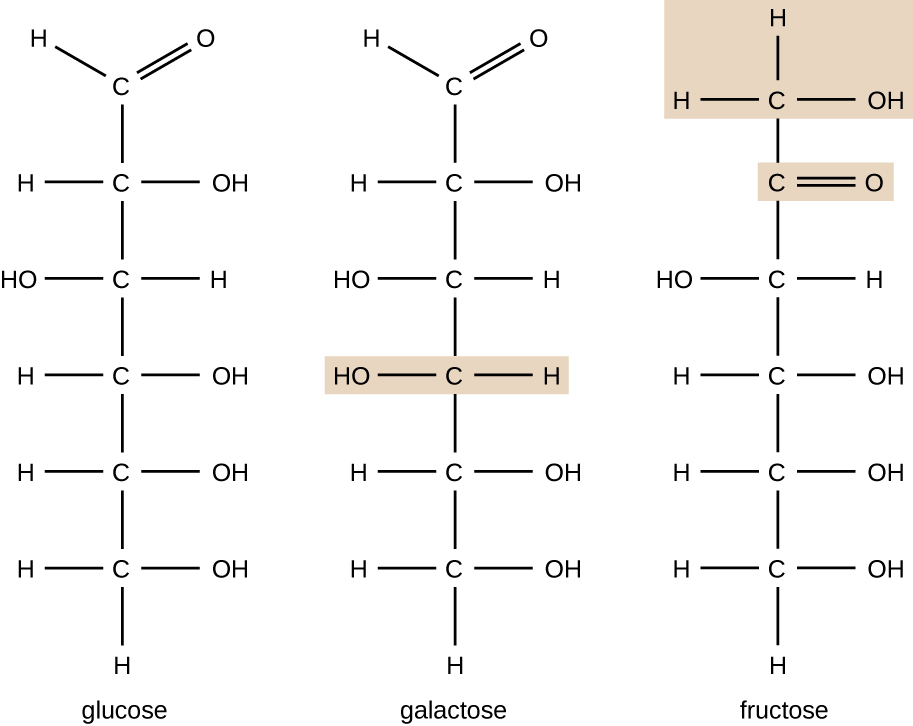
molekyler med samma atommakeup men olika strukturella arrangemang av atomer kallas isomerer. Begreppet isomerism är mycket viktigt i kemi eftersom strukturen hos en molekyl alltid är direkt relaterad till dess funktion. Små förändringar i de strukturella arrangemangen hos atomer i en molekyl kan leda till mycket olika egenskaper. Kemister representerar molekyler med sin strukturformel, som är en grafisk representation av molekylstrukturen, som visar hur atomerna är ordnade. Föreningar som har identiska molekylformler men skiljer sig åt i atomernas bindningssekvens kallas strukturella isomerer. Monosackariderna glukos, galaktos och fruktos har alla samma molekylformel, C6H12O6, men vi kan se från Figur \(\PageIndex{3}\) att atomerna är bundna ihop olika.
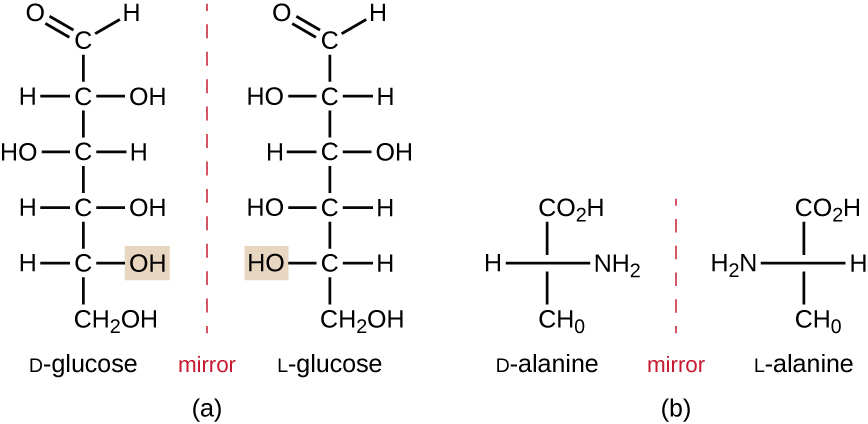
isomerer som skiljer sig åt i atomernas rumsliga arrangemang kallas stereoisomerer; en unik typ är enantiomerer. Egenskaperna hos enantiomerer upptäcktes ursprungligen av Louis Pasteur 1848 medan man använde ett mikroskop för att analysera kristalliserade jäsningsprodukter av vin. Enantiomerer är molekyler som har karaktäristiken för chiralitet, där deras strukturer är nonsuperimposable spegelbilder av varandra. Chiralitet är en viktig egenskap i många biologiskt viktiga molekyler, vilket illustreras av exemplen på strukturella skillnader i de enantiomera formerna av monosackaridglukosen eller aminosyran alanin (figur \(\PageIndex{4}\)).
många organismer kan bara använda en enantiomer form av vissa typer av molekyler som näringsämnen och som byggstenar för att skapa strukturer i en cell. Vissa enantiomera former av aminosyror har tydligt olika smaker och dofter när de konsumeras som mat. Till exempel smakar L-aspartam, vanligtvis kallad aspartam, söt, medan D-aspartam är smaklös. Drog enantiomerer kan ha mycket olika farmakologiska effekter. Till exempel finns föreningen metorfan som två enantiomerer, varav en fungerar som en antitussiv (dextrometorfan, ett hostdämpande medel), medan den andra fungerar som ett smärtstillande medel (levometorfan, ett läkemedel som liknar kodin).
enantiomerer kallas också optiska isomerer eftersom de kan rotera planet för polariserat ljus. Några av kristallerna Pasteur observerade från vinjäsning roterade ljus medurs medan andra roterade ljuset moturs. Idag betecknar vi enantiomerer som roterar polariserat ljus medurs (+) som d − former och spegelbilden av samma molekyl som roterar polariserat ljus moturs ( – ) som l-formen. D-och l-etiketterna härrör från de latinska orden dexter (till höger) respektive laevus (till vänster). Dessa två olika optiska isomerer har ofta mycket olika biologiska egenskaper och aktiviteter. Vissa arter av mögel, jäst och bakterier, såsom Rhizopus, Yarrowia och Lactobacillus spp., respektive, kan endast metabolisera en typ av optisk isomer; den motsatta isomeren är inte lämplig som en källa till näringsämnen. En annan viktig anledning att vara medveten om optiska isomerer är den terapeutiska användningen av dessa typer av kemikalier för läkemedelsbehandling, eftersom vissa mikroorganismer endast kan påverkas av en specifik optisk isomer.
övning \(\PageIndex{3}\)
vi säger att livet är kolbaserat. Vad gör kol så lämpligt att vara en del av alla makromolekyler av levande organismer?