7.1: Moléculas orgánicas
Moléculas orgánicas e isomerismo
Las moléculas orgánicas en los organismos son generalmente más grandes y más complejas que las moléculas inorgánicas. Sus esqueletos de carbono se mantienen unidos por enlaces covalentes. Forman las células de un organismo y realizan las reacciones químicas que facilitan la vida. Todas estas moléculas, llamadas biomoléculas porque son parte de la materia viva, contienen carbono, que es el componente básico de la vida. El carbono es un elemento único en el sentido de que tiene cuatro electrones de valencia en sus orbitales exteriores y puede formar cuatro enlaces covalentes individuales con hasta otros cuatro átomos al mismo tiempo (véase el Apéndice A). Estos átomos son generalmente oxígeno, hidrógeno, nitrógeno, azufre, fósforo y carbono en sí; el compuesto orgánico más simple es el metano, en el que el carbono se une solo al hidrógeno (Figura \(\pageIndex{2}\)).
Como resultado de la combinación única de tamaño y propiedades de unión del carbono, los átomos de carbono pueden unirse en grandes cantidades, produciendo así una cadena o esqueleto de carbono. El esqueleto de carbono de las moléculas orgánicas puede ser recto, ramificado o en forma de anillo (cíclico). Las moléculas orgánicas se construyen sobre cadenas de átomos de carbono de longitudes variables; la mayoría son típicamente muy largas, lo que permite una gran cantidad y variedad de compuestos. Ningún otro elemento tiene la capacidad de formar tantas moléculas diferentes de tantos tamaños y formas diferentes.
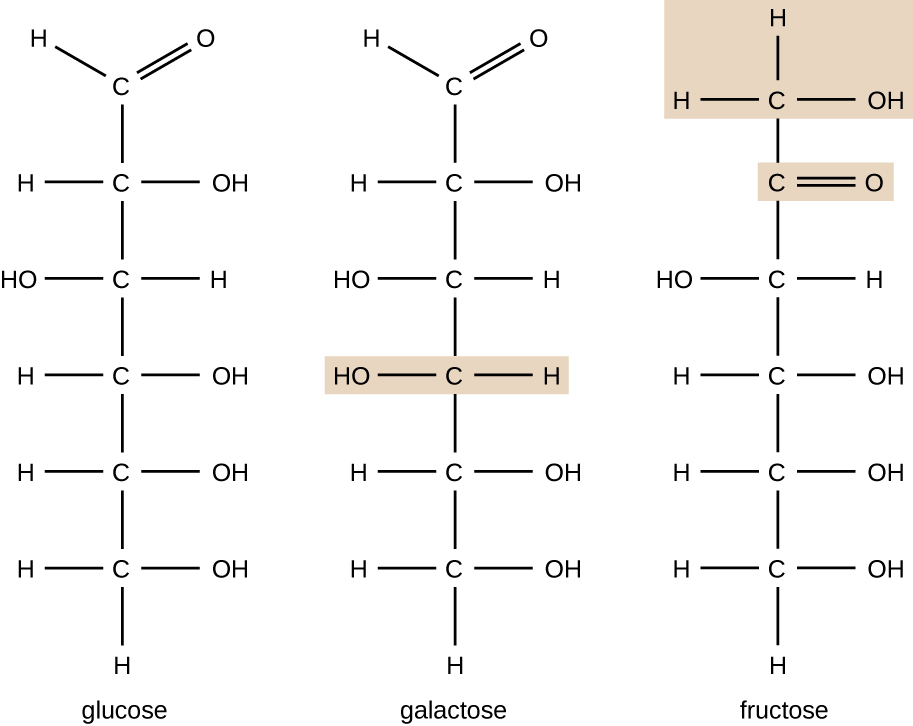
Las moléculas con la misma composición atómica pero diferente disposición estructural de los átomos se llaman isómeros. El concepto de isomerismo es muy importante en química porque la estructura de una molécula está siempre directamente relacionada con su función. Cambios leves en la disposición estructural de los átomos en una molécula pueden conducir a propiedades muy diferentes. Los químicos representan las moléculas por su fórmula estructural, que es una representación gráfica de la estructura molecular, que muestra cómo están dispuestos los átomos. Los compuestos que tienen fórmulas moleculares idénticas pero difieren en la secuencia de enlace de los átomos se denominan isómeros estructurales. Los monosacáridos glucosa, galactosa y fructosa tienen la misma fórmula molecular, C6H12O6, pero podemos ver en la Figura \(\pageIndex{3}\) que los átomos están unidos de manera diferente.
Los isómeros que difieren en la disposición espacial de los átomos se denominan estereoisómeros; un tipo único son los enantiómeros. Las propiedades de los enantiómeros fueron descubiertas originalmente por Louis Pasteur en 1848 mientras usaba un microscopio para analizar productos de fermentación cristalizados de vino. Los enantiómeros son moléculas que tienen la característica de quiralidad, en las que sus estructuras son imágenes especulares no superables unas de otras. La quiralidad es una característica importante en muchas moléculas biológicamente importantes, como lo ilustran los ejemplos de diferencias estructurales en las formas enantioméricas del monosacárido glucosa o el aminoácido alanina (Figura \(\pageIndex{4}\)).
Muchos organismos solo pueden usar una forma enantiomérica de ciertos tipos de moléculas como nutrientes y como bloques de construcción para crear estructuras dentro de una célula. Algunas formas enantioméricas de aminoácidos tienen sabores y olores claramente diferentes cuando se consumen como alimentos. Por ejemplo, el L-aspartamo, comúnmente llamado aspartamo, tiene un sabor dulce, mientras que el D-aspartamo no tiene sabor. Los enantiómeros de los medicamentos pueden tener efectos farmacológicos muy diferentes. Por ejemplo, el compuesto metorfano existe como dos enantiómeros, uno de los cuales actúa como antitusivo (dextrometorfano, un supresor de la tos), mientras que el otro actúa como analgésico (levometorfano, un medicamento similar en efecto a la codeína).
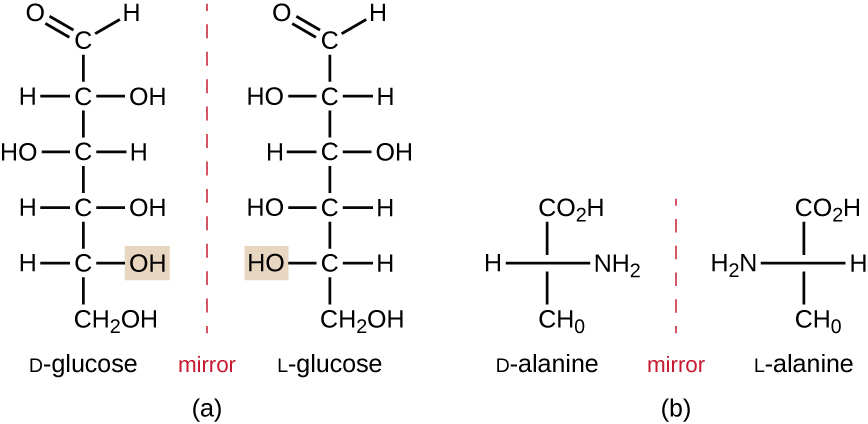
Los enantiómeros también se denominan isómeros ópticos porque pueden girar el plano de la luz polarizada. Algunos de los cristales que Pasteur observó de la fermentación del vino giraban la luz en el sentido de las agujas del reloj, mientras que otros giraban la luz en el sentido contrario a las agujas del reloj. Hoy en día, denotamos enantiómeros que giran la luz polarizada en el sentido de las agujas del reloj (+) como formas d, y la imagen especular de la misma molécula que gira la luz polarizada en el sentido contrario a las agujas del reloj (−) como la forma l. Las etiquetas d y l se derivan de las palabras latinas dexter (a la derecha) y laevus (a la izquierda), respectivamente. Estos dos isómeros ópticos diferentes a menudo tienen propiedades y actividades biológicas muy diferentes. Ciertas especies de mohos, levaduras y bacterias, como Rhizopus, Yarrowia y Lactobacillus spp. respectivamente, solo puede metabolizar un tipo de isómero óptico; el isómero opuesto no es adecuado como fuente de nutrientes. Otra razón importante para ser consciente de los isómeros ópticos es el uso terapéutico de estos tipos de productos químicos para el tratamiento farmacológico, porque algunos microorganismos solo pueden verse afectados por un isómero óptico específico.
Ejercicio \ (\pageIndex{3}\)
Decimos que la vida se basa en el carbono. ¿Qué hace que el carbono sea tan adecuado para formar parte de todas las macromoléculas de los organismos vivos?