7.1: organiske molekyler
organiske molekyler og isomerisme
organiske molekyler i organismer er generelt større og mere komplekse end uorganiske molekyler. Deres kulstofskeletter holdes sammen af kovalente bindinger. De danner cellerne i en organisme og udfører de kemiske reaktioner, der letter livet. Alle disse molekyler, kaldet biomolekyler, fordi de er en del af levende stof, indeholder kulstof, som er livets byggesten. Kulstof er et meget unikt element, idet det har fire valenselektroner i dets ydre orbitaler og kan danne fire enkeltkovalente bindinger med op til fire andre atomer på samme tid (Se bilag A). Disse atomer er normalt ilt, brint, nitrogen, svovl, fosfor og kulstof i sig selv; den enkleste organiske forbindelse er methan, hvor kulstof kun binder til brint (figur \(\Sideindeks{2}\)).
som et resultat af carbon ‘ s unikke kombination af størrelse og bindingsegenskaber kan carbonatomer binde sammen i stort antal og således producere et kæde-eller carbonskelet. Carbonskeletet af organiske molekyler kan være lige, forgrenet eller ringformet (cyklisk). Organiske molekyler er bygget på kæder af carbonatomer af forskellig længde; de fleste er typisk meget lange, hvilket giver mulighed for et stort antal og forskellige forbindelser. Intet andet element har evnen til at danne så mange forskellige molekyler af så mange forskellige størrelser og former.
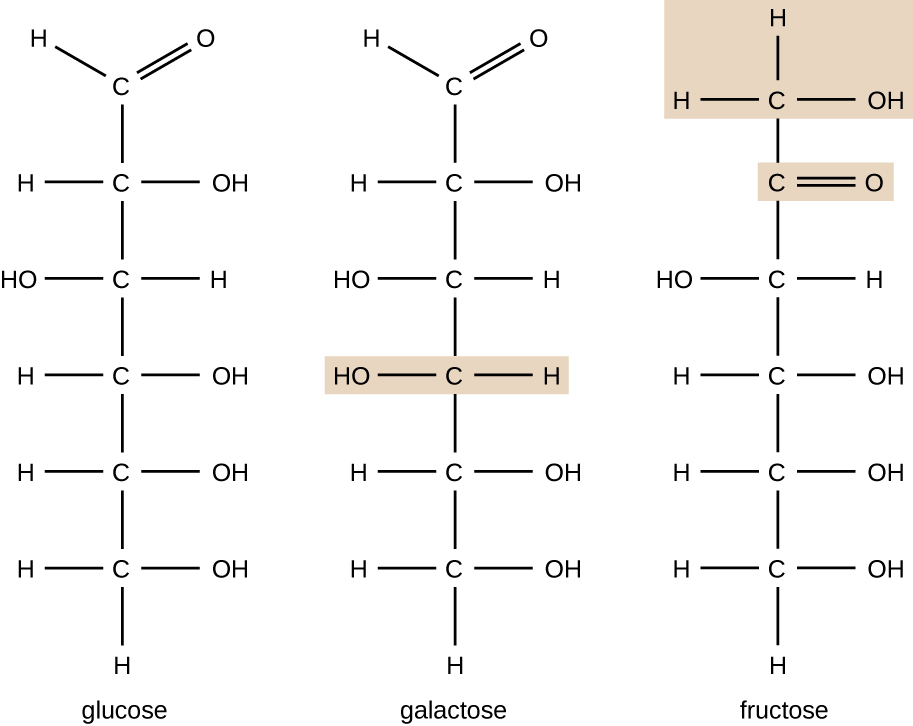
molekyler med samme atomiske sammensætning, men forskellige strukturelle arrangement af atomer kaldes isomerer. Begrebet isomerisme er meget vigtigt i kemi, fordi strukturen af et molekyle altid er direkte relateret til dets funktion. Små ændringer i de strukturelle arrangementer af atomer i et molekyle kan føre til meget forskellige egenskaber. Kemikere repræsenterer molekyler ved deres strukturformel, som er en grafisk repræsentation af den molekylære struktur, der viser, hvordan atomerne er arrangeret. Forbindelser, der har identiske molekylære formler, men adskiller sig i bindingssekvensen for atomerne kaldes strukturelle isomerer. Monosacchariderne glucose, galactose og fructose har alle den samme molekylformel, C6H12O6, men vi kan se fra Figur \(\Sideindeks{3}\), at atomerne er bundet sammen forskelligt.
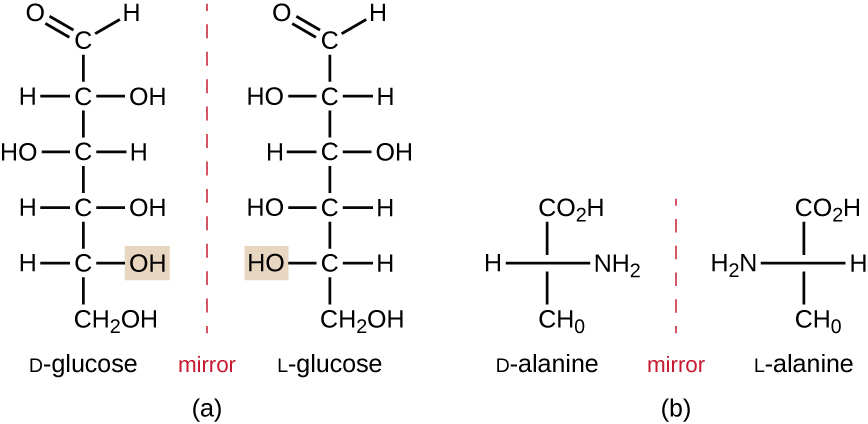
isomerer, der adskiller sig i atomernes rumlige arrangementer, kaldes stereoisomerer; en unik type er enantiomerer. Egenskaberne af enantiomerer blev oprindeligt opdaget af Louis Pasteur i 1848, mens man brugte et mikroskop til at analysere krystalliserede gæringsprodukter af vin. Enantiomerer er molekyler, der har karakteristika for chiralitet, hvor deres strukturer er nonsuperimposable spejlbilleder af hinanden. Chiralitet er en vigtig egenskab i mange biologisk vigtige molekyler, som illustreret ved eksemplerne på strukturelle forskelle i de enantiomere former af monosaccharidglukosen eller aminosyren alanin (figur \(\Sideindeks{4}\)).
mange organismer er kun i stand til at bruge en enantiomere form af visse typer molekyler som næringsstoffer og som byggesten til at skabe strukturer i en celle. Nogle enantiomere former for aminosyrer har tydeligt forskellige smag og lugt, når de indtages som mad. For eksempel smager L-aspartam, der almindeligvis kaldes aspartam, sødt, mens D-aspartam er smagløst. Drug enantiomerer kan have meget forskellige farmakologiske påvirker. For eksempel findes forbindelsen methorphan som to enantiomerer, hvoraf den ene fungerer som et antitussivt middel (dekstromethorphan, et hostehæmmende middel), mens den anden fungerer som et smertestillende middel (levomethorphan, et lægemiddel, der ligner kodein).
enantiomerer kaldes også optiske isomerer, fordi de kan rotere planet for polariseret lys. Nogle af krystallerne Pasteur observeret fra vingæring roterede lys med uret, mens andre roterede lyset mod uret. I dag betegner vi enantiomerer, der roterer polariseret lys med uret (+) som D − former, og spejlbilledet af det samme molekyle, der roterer polariseret lys mod uret ( – ) som l-form. D-og L-etiketterne er afledt af de latinske ord behændighed (til højre) og laevus (til venstre), henholdsvis. Disse to forskellige optiske isomerer har ofte meget forskellige biologiske egenskaber og aktiviteter. Visse arter af skimmelsvampe, gær og bakterier, såsom jordstængler, røllike og Lactobacillus spp. henholdsvis kan kun metabolisere en type optisk isomer; den modsatte isomer er ikke egnet som en kilde til næringsstoffer. En anden vigtig grund til at være opmærksom på optiske isomerer er den terapeutiske anvendelse af disse typer kemikalier til lægemiddelbehandling, fordi nogle mikroorganismer kun kan påvirkes af en specifik optisk isomer.
øvelse \(\Sideindeks{3}\)
Vi siger, at livet er kulstofbaseret. Hvad gør kulstof så egnet til at være en del af alle levende organismers makromolekyler?