7.1: Organiske Molekyler
Organiske Molekyler og Isomerisme
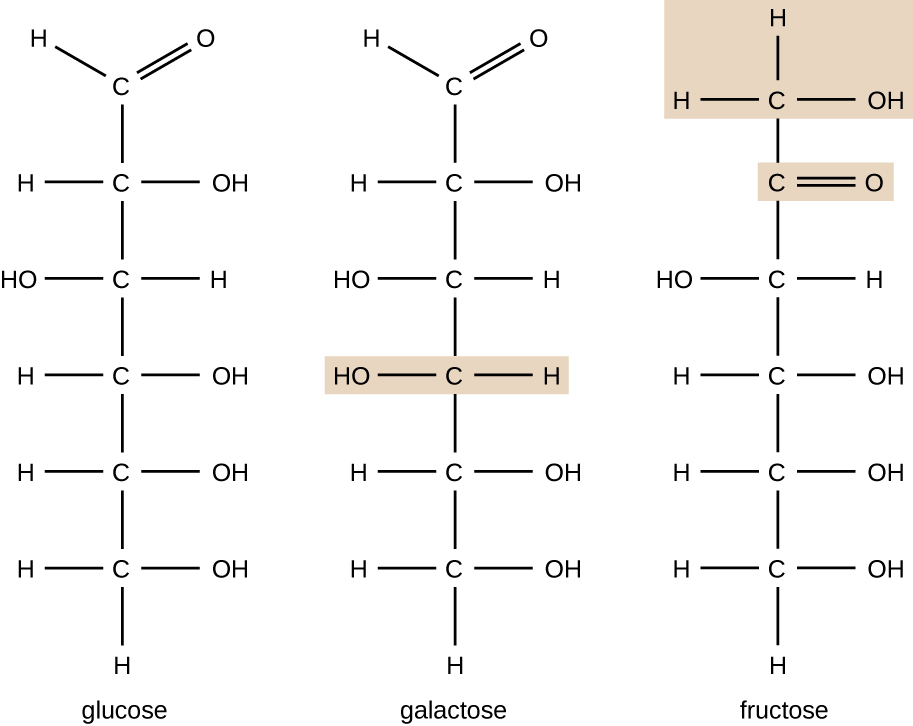
Organiske molekyler i organismer er generelt større og mer komplekse enn uorganiske molekyler. Deres karbonskjeletter holdes sammen av kovalente bindinger. De danner cellene i en organisme og utfører de kjemiske reaksjonene som letter livet. Alle disse molekylene, kalt biomolekyler fordi de er en del av levende materie, inneholder karbon, som er byggesteinen i livet. Karbon er et veldig unikt element ved at det har fire valenselektroner i sine ytre orbitaler og kan danne fire enkle kovalente bindinger med opptil fire andre atomer samtidig (Se Vedlegg A). Disse atomene er vanligvis oksygen, hydrogen, nitrogen, svovel, fosfor og karbon i seg selv; den enkleste organiske forbindelsen er metan, hvor karbon bare binder seg til hydrogen (Figur \ (\PageIndex{2}\)).som et resultat av karbonens unike kombinasjon av størrelse og bindingsegenskaper, kan karbonatomer binde sammen i store mengder, og dermed produsere en kjede eller karbonskjelett. Karbonskjelettet av organiske molekyler kan være rett, forgrenet eller ringformet (syklisk). Organiske molekyler er bygget på kjeder av karbonatomer av varierende lengder; de fleste er vanligvis veldig lange, noe som gir et stort antall og forskjellige forbindelser. Intet annet element har evnen til å danne så mange forskjellige molekyler av så mange forskjellige størrelser og former.Molekyler med samme atom sminke, men forskjellige strukturelle arrangement av atomer kalles isomerer. Begrepet isomerisme er svært viktig i kjemi fordi strukturen av et molekyl alltid er direkte relatert til dets funksjon. Små endringer i de strukturelle arrangementene av atomer i et molekyl kan føre til svært forskjellige egenskaper. Kjemikere representerer molekyler ved deres strukturelle formel, som er en grafisk representasjon av molekylstrukturen, som viser hvordan atomene er ordnet. Forbindelser som har identiske molekylære formler, men varierer i bindingssekvensen av atomene kalles strukturelle isomerer. Monosakkaridene glukose, galaktose og fruktose har alle samme molekylformel, C6H12O6, men Vi kan se Fra Figur \(\PageIndex{3}\) at atomene er bundet sammen annerledes.
Isomerer som avviker i romlige arrangementer av atomer kalles stereoisomerer; en unik type er enantiomerer. Egenskapene til Enantiomerer ble opprinnelig oppdaget Av Louis Pasteur i 1848 mens de brukte et mikroskop for å analysere krystalliserte gjæringsprodukter av vin. Enantiomerer er molekyler som har karakteristikken for kiralitet, hvor deres strukturer er ikke-uovervinnelige speilbilder av hverandre. Kiralitet er en viktig egenskap i mange biologisk viktige molekyler, som illustrert av eksemplene på strukturelle forskjeller i de enantiomere former av monosakkaridglukosen eller aminosyrealanin(Figur \(\PageIndex{4}\)).Mange organismer er bare i stand til å bruke en enantiomer form av visse typer molekyler som næringsstoffer og som byggesteiner for å lage strukturer i en celle. Noen enantiomere former for aminosyrer har tydelig forskjellig smak og lukt når de forbrukes som mat. For Eksempel Smaker L-aspartam, ofte kalt aspartam, søtt, mens D-aspartam er smakløst. Drug enantiomers kan ha svært forskjellige farmakologiske påvirker. For eksempel eksisterer forbindelsen metorfan som to enantiomerer, hvorav den ene virker som en antitussiv (dextrometorfan, en hosteundertrykkende), mens den andre virker som en analgetisk (levometorfan,et stoff som ligner på kodein).
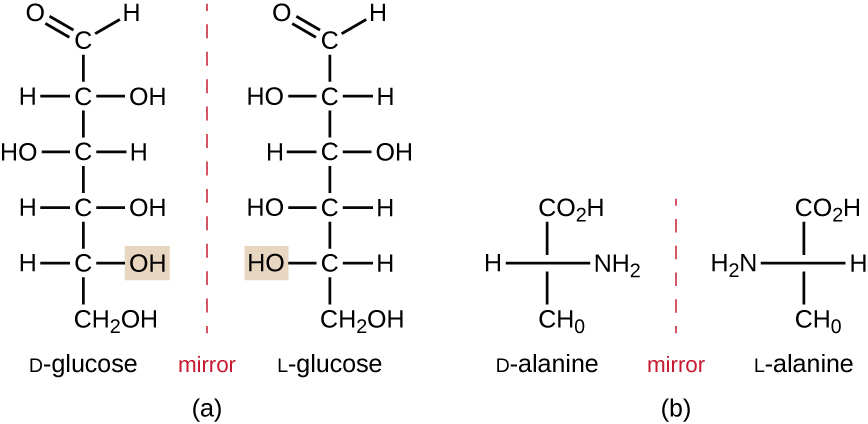
enantiomerer kalles også optiske isomerer fordi de kan rotere planet av polarisert lys. Noen av krystallene Pasteur observert fra vinfermentering roterte lys med urviseren mens andre roterte lyset mot klokka. I dag betegner vi enantiomerer som roterer polarisert lys med klokken ( + ) som d − former, og speilbildet av det samme molekylet som roterer polarisert lys mot klokken ( – ) som l-formen. D-og l-etikettene er avledet fra de latinske ordene dexter (til høyre) og laevus (til venstre), henholdsvis. Disse to forskjellige optiske isomerer har ofte svært forskjellige biologiske egenskaper og aktiviteter. Visse arter av mugg, gjær og bakterier, som Rhizopus, Yarrowia og Lactobacillus spp., henholdsvis, kan bare metabolisere en type optisk isomer; motsatt isomer er ikke egnet som en kilde til næringsstoffer. En annen viktig grunn til å være oppmerksom på optiske isomerer er terapeutisk bruk av disse typer kjemikalier for narkotikabehandling, fordi enkelte mikroorganismer kun kan påvirkes av en bestemt optisk isomer.
Øvelse \(\PageIndex{3}\)
Vi sier at livet er karbonbasert. Hva gjør karbon så egnet til å være en del av alle makromolekyler av levende organismer?