7.1: Organic Molecules
Organic Molecules and Isomerism
Organic molecules in organisms are generally larger and more complex than inorganic molecules. I loro scheletri di carbonio sono tenuti insieme da legami covalenti. Formano le cellule di un organismo ed eseguono le reazioni chimiche che facilitano la vita. Tutte queste molecole, chiamate biomolecole perché fanno parte della materia vivente, contengono carbonio, che è l’elemento costitutivo della vita. Il carbonio è un elemento molto particolare in quanto ha quattro elettroni di valenza nei suoi orbitali esterni e può formare quattro singoli legami covalenti con fino a quattro altri atomi contemporaneamente (vedi Appendice A). Questi atomi sono solitamente ossigeno, idrogeno, azoto, zolfo, fosforo e carbonio stesso; il composto organico più semplice è il metano, in cui il carbonio si lega solo all’idrogeno (Figura \(\PageIndex{2}\)).
Come risultato della combinazione unica di dimensioni e proprietà di legame del carbonio, gli atomi di carbonio possono legarsi insieme in gran numero, producendo così una catena o uno scheletro di carbonio. Lo scheletro di carbonio delle molecole organiche può essere dritto, ramificato o a forma di anello (ciclico). Le molecole organiche sono costruite su catene di atomi di carbonio di varie lunghezze; la maggior parte sono in genere molto lunghe, il che consente un numero enorme e una varietà di composti. Nessun altro elemento ha la capacità di formare così tante molecole diverse di così tante dimensioni e forme diverse.
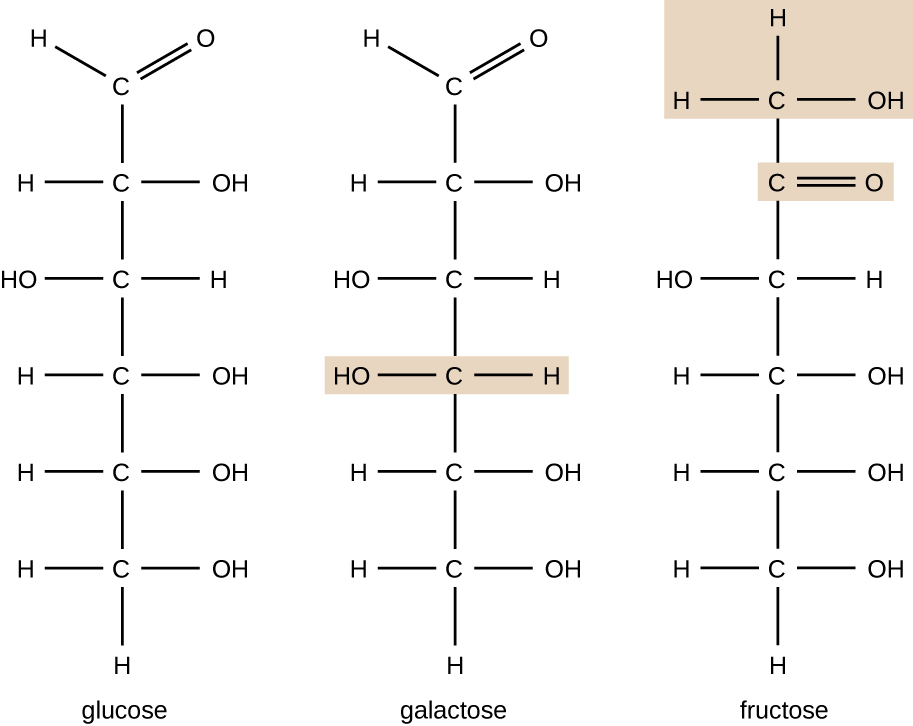
Molecole con la stessa composizione atomica ma diversa disposizione strutturale degli atomi sono chiamati isomeri. Il concetto di isomerismo è molto importante in chimica perché la struttura di una molecola è sempre direttamente correlata alla sua funzione. Lievi cambiamenti nelle disposizioni strutturali degli atomi in una molecola possono portare a proprietà molto diverse. I chimici rappresentano le molecole con la loro formula strutturale, che è una rappresentazione grafica della struttura molecolare, che mostra come sono disposti gli atomi. I composti che hanno formule molecolari identiche ma differiscono nella sequenza di legame degli atomi sono chiamati isomeri strutturali. I monosaccaridi glucosio, galattosio e fruttosio hanno tutti la stessa formula molecolare, C6H12O6, ma possiamo vedere dalla figura \(\PageIndex{3}\) che gli atomi sono legati insieme in modo diverso.
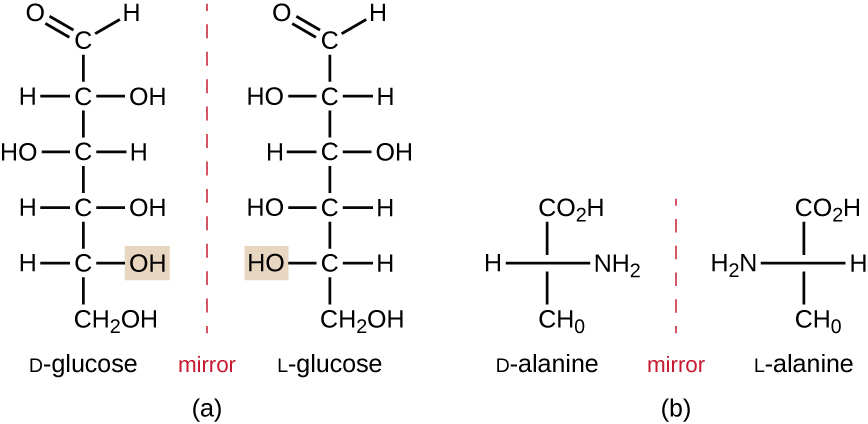
Gli isomeri che differiscono nelle disposizioni spaziali degli atomi sono chiamati stereoisomeri; un tipo unico è enantiomeri. Le proprietà degli enantiomeri furono originariamente scoperte da Louis Pasteur nel 1848 mentre utilizzava un microscopio per analizzare i prodotti di fermentazione cristallizzati del vino. Gli enantiomeri sono molecole che hanno la caratteristica della chiralità, in cui le loro strutture sono immagini speculari non superimposabili l’una dell’altra. La chiralità è una caratteristica importante in molte molecole biologicamente importanti, come illustrato dagli esempi di differenze strutturali nelle forme enantiomeriche del monosaccaride glucosio o dell’amminoacido alanina (Figura \(\PageIndex{4}\)).
Molti organismi sono in grado di utilizzare solo una forma enantiomerica di alcuni tipi di molecole come nutrienti e come elementi costitutivi per creare strutture all’interno di una cellula. Alcune forme enantiomeriche di aminoacidi hanno gusti e odori nettamente diversi se consumati come cibo. Ad esempio, L-aspartame, comunemente chiamato aspartame, ha un sapore dolce, mentre D-aspartame è insapore. Gli enantiomeri della droga possono avere effetti farmacologici molto diversi. Ad esempio, il metorfano composto esiste come due enantiomeri, uno dei quali agisce come antitosse (destrometorfano, un soppressore della tosse), mentre l’altro agisce come analgesico (levometorfano, un farmaco simile in effetti alla codeina).
Gli enantiomeri sono anche chiamati isomeri ottici perché possono ruotare il piano della luce polarizzata. Alcuni dei cristalli Pasteur osservati dalla fermentazione del vino ruotato luce in senso orario, mentre altri ruotato la luce in senso antiorario. Oggi denotiamo gli enantiomeri che ruotano la luce polarizzata in senso orario ( + ) come forme d e l’immagine speculare della stessa molecola che ruota la luce polarizzata in senso antiorario ( − ) come forma L. Le etichette d e l derivano rispettivamente dalle parole latine dexter (a destra) e laevus (a sinistra). Questi due diversi isomeri ottici hanno spesso proprietà e attività biologiche molto diverse. Alcune specie di muffe, lieviti e batteri, come Rhizopus, Yarrowia e Lactobacillus spp., rispettivamente, può metabolizzare solo un tipo di isomero ottico; l’isomero opposto non è adatto come fonte di nutrienti. Un altro motivo importante per essere consapevoli degli isomeri ottici è l’uso terapeutico di questi tipi di sostanze chimiche per il trattamento farmacologico, perché alcuni microrganismi possono essere influenzati solo da uno specifico isomero ottico.
Esercizio \(\PageIndex{3}\)
Diciamo che la vita è basata sul carbonio. Cosa rende il carbonio così adatto a far parte di tutte le macromolecole degli organismi viventi?