7.1: Moléculas Orgânicas
Moléculas Orgânicas e Isomerism
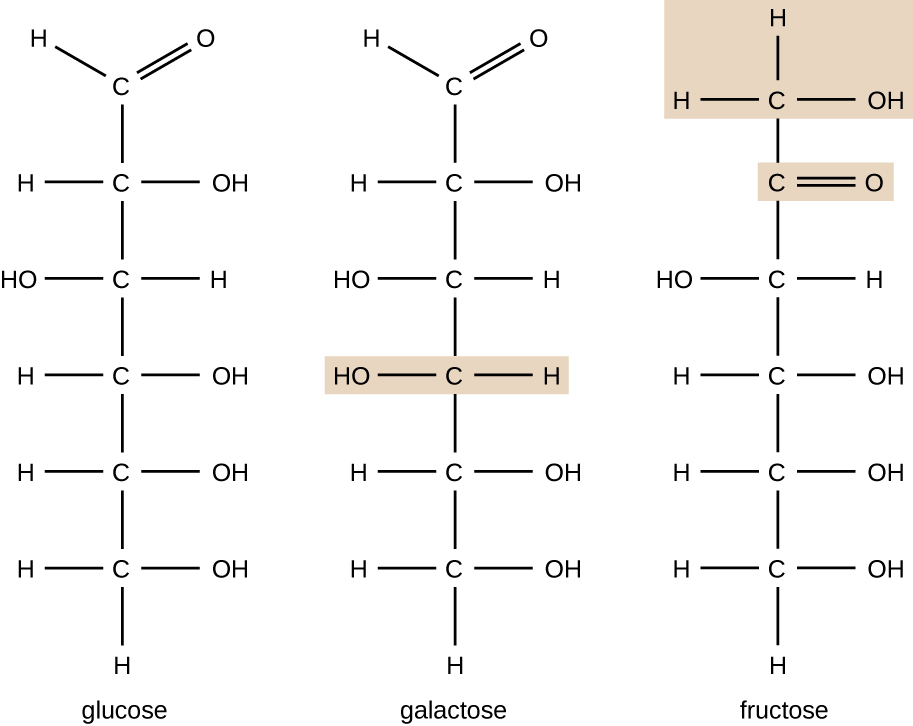
as moléculas Orgânicas em organismos são geralmente maiores e mais complexas de moléculas inorgânicas. Seus esqueletos de carbono são mantidos juntos por ligações covalentes. Eles formam as células de um organismo e realizam as reações químicas que facilitam a vida. Todas estas moléculas, chamadas biomoléculas porque fazem parte da matéria viva, contêm carbono, que é o bloco de construção da vida. O carbono é um elemento muito único na medida em que tem quatro elétrons de Valência em seus orbitais externos e pode formar quatro ligações covalentes únicas com até quatro outros átomos ao mesmo tempo (ver Apêndice A). Estes átomos são geralmente oxigênio, hidrogênio, nitrogênio, enxofre, fósforo e carbono em si; o composto orgânico mais simples é o metano, no qual o carbono se liga apenas ao hidrogênio (figura \(\PageIndex{2}\)).como resultado da combinação única de tamanho e propriedades de ligação do carbono, átomos de carbono podem unir-se em grande número, produzindo assim uma cadeia ou esqueleto de carbono. O esqueleto de carbono de moléculas orgânicas pode ser reto, ramificado ou em forma de anel (Cíclico). Moléculas orgânicas são construídas sobre cadeias de átomos de carbono de diferentes comprimentos; a maioria são tipicamente muito longas, o que permite um grande número e variedade de compostos. Nenhum outro elemento tem a capacidade de formar tantas moléculas diferentes de tantos tamanhos e formas diferentes.moléculas com a mesma composição atômica, mas diferentes arranjos estruturais de átomos são chamados isômeros. O conceito de isomerismo é muito importante na química porque a estrutura de uma molécula está sempre diretamente relacionada com sua função. Ligeiras alterações nos arranjos estruturais dos átomos de uma molécula podem levar a propriedades muito diferentes. Os químicos representam moléculas por sua fórmula estrutural, que é uma representação gráfica da estrutura molecular, mostrando como os átomos são dispostos. Compostos que têm fórmulas moleculares idênticas, mas diferem na sequência de ligação dos átomos são chamados isômeros estruturais. Os monossacarídeos glucose, galactose e frutose têm todas a mesma fórmula molecular, C6H12O6, mas podemos ver pela figura \(\PageIndex{3}\) que os átomos estão ligados de forma diferente.
isómeros que diferem nas disposições espaciais dos átomos são chamados estereoisómeros; um tipo único é os enantiómeros. As propriedades dos enantiômeros foram originalmente descobertas por Louis Pasteur em 1848, usando um microscópio para analisar produtos cristalizados de fermentação do vinho. Enantiômeros são moléculas que têm a característica de chiralidade, em que suas estruturas são imagens espelhadas não superimposíveis um do outro. A quiralidade é uma característica importante em muitas moléculas biologicamente importantes, como ilustrado pelos exemplos de diferenças estruturais nas formas enantioméricas da glucose monossacárida ou do aminoácido alanina (figura \(\PageIndex{4}\)).muitos organismos apenas são capazes de usar uma forma enantiomérica de certos tipos de moléculas como nutrientes e como blocos de construção para fazer estruturas dentro de uma célula. Algumas formas enantioméricas de aminoácidos têm gostos e cheiros distintamente diferentes quando consumidos como alimento. Por exemplo, o L-aspartame, comumente chamado aspartame, tem um sabor doce, enquanto que o D-aspartame não tem sabor. Os enantiómeros de fármacos podem ter efeitos farmacológicos muito diferentes. Por exemplo, o composto metamorfano existe como dois enantiômeros, um dos quais atua como um antitussivo (dextrometorfano, um supressor da tosse), enquanto o outro atua como um analgésico (levometorfano, uma droga similar em efeito à codeína).
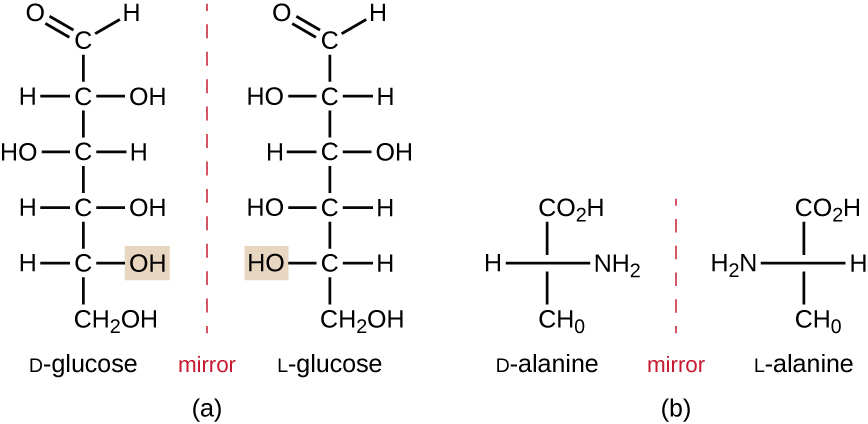
enantiômeros também são chamados isômeros ópticos porque eles podem rodar o plano da luz polarizada. Alguns dos cristais Pasteur observados a partir da fermentação do vinho rodaram no sentido horário, enquanto outros rodaram a luz no sentido anti-horário. Hoje, nós denotamos enantiômeros que giram luz polarizada no sentido horário ( + ) como forma d, e a imagem Espelho da mesma molécula que roda luz polarizada no sentido anti − horário ( – ) como a forma l. Os rótulos d E l são derivados das palavras latinas dexter (à direita) e laevus (à esquerda), respectivamente. Estes dois isómeros ópticos diferentes têm frequentemente propriedades e actividades biológicas muito diferentes. Certas espécies de moldes, leveduras e bactérias, tais como Rhizopus, Yarrowia e Lactobacillus spp., respectivamente, só pode metabolizar um tipo de isómero óptico; o isómero oposto não é adequado como fonte de nutrientes. Outra razão importante para estar ciente dos isómeros ópticos é o uso terapêutico destes tipos de produtos químicos para o tratamento da toxicodependência, porque alguns microrganismos só podem ser afectados por um isómero óptico específico.
exercício \(\PageIndex{3}\)
dizemos que a vida é baseada no carbono. O que torna o carbono tão adequado para fazer parte de todas as macromoléculas de organismos vivos?