Wo sind all die Gefäßgerüste hin?
EINLEITUNG
Das infrainguinale arterielle Gefäßsystem stellt aufgrund komplexer Kräfte auf die Arterien, die bei Bewegungen der unteren Extremitäten auftreten, eine herausfordernde Untergruppe für die endovaskuläre Behandlung dar. Arterielle Torsion, Flexion, Extension und Kompression sind Beispiele für diese Kräfte, die nach der Behandlung zu Stentfrakturen und höheren Restenoseraten führen können.1 Während der venöse Gefäßbypass der femoropoplitealen (FP) Segmente mit einer Durchgängigkeit von etwa 75% nach 5 Jahren eine praktikable Option bleibt, wird er häufig erst nach einem fehlgeschlagenen endovaskulären Ansatz verwendet. Wenn keine venöse Leitung verfügbar ist, müssen bioprothetische Transplantate mit einer viel geringeren Durchgängigkeit von 5 Jahren (weniger als 50%) verwendet werden.2
Mehrere Studien haben eine überlegene Durchgängigkeit mit Stents gegenüber der perkutanen transluminalen Angioplastie (PTA) allein bei der Behandlung von FP-Segmenten gezeigt.1,3,4 Dieser Vorteil wird durch die erhöhte Komplexität der Behandlung beim Versagen dieser Stents etwas gemildert. Die Einführung der Drug Eluting Stent (DES) -Technologie hat die Durchgängigkeit des primären Stents weiter verbessert; Ihre Verwendung wurde jedoch durch die jüngsten Warnungen der Food and Drug Administration (FDA) gemildert, die die Geräte mit einer höheren Mortalität in Verbindung bringen.5 Diese Bedenken wurden nach Veröffentlichung einer Metaanalyse randomisierter kontrollierter Studien mit Paclitaxel-beschichteten Geräten geäußert, die einen Anstieg der Mortalität ab 2 Jahren zeigten. Während mehrere nachfolgende Studien, einschließlich einer großen Analyse von >16.000 Medicare-Patienten, diese Hypothese nicht bestätigten, hat sich die Verwendung der Geräte vorübergehend verlangsamt.6-9
Dies lässt eine große potenzielle Rolle für neue Technologien wie bioabsorbierbare Gefäßgerüste (BVS), die eine verbesserte frühe Durchgängigkeit bieten und gleichzeitig nachgelagerte Probleme wie In-Stent-Restenose mildern können. In dieser Übersicht werden wir die verschiedenen verfügbaren Behandlungen von diskutieren periphere arterielle Verschlusskrankheit und Bewertung der Zukunft von Gefäßstents / Gerüsten sowohl im femoropoplitealen als auch unterhalb des Knies Gefäße.
STENTING BEI FEMOROPOPLITEALER ERKRANKUNG
Bare-Metal-Stents
Während die derzeitige endovaskuläre Gefäßpraxis aufgrund der oben beschriebenen Probleme den Versuch bevorzugt, die Platzierung von Stents als Erstbehandlung zu vermeiden, gibt es weiterhin wichtige Indikationen für das Stenting, wie z. B. Reststenose nach PTA und flussbegrenzende Dissektion.1 Die kombinierten ACC / AHA / SCAI / SIR / SVM „Appropriate Use Criteria“ besagen, dass bei Patienten mit optimaler medizinischer Therapie das endovaskuläre Stenting der stenotischen FP-Erkrankung für Claudicatio und kritische Extremitätenischämie geeignet ist (Abbildungen 1a-c).10
Abbildung 1a. Geeignete Verwendungskriterien für Claudicatio Intermittens trotz leitliniengerichteter medizinischer Therapie.
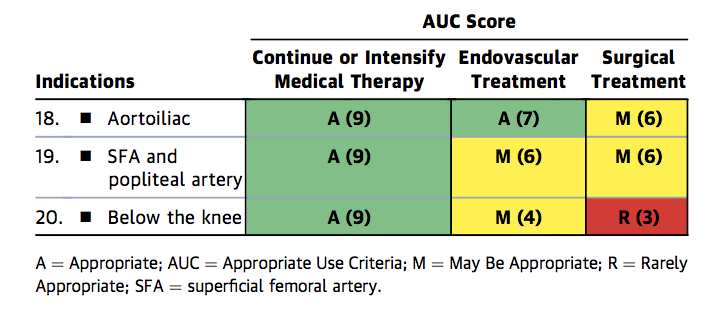
Abbildung 1a

Abbildung 1b. Appropriate Use Criteria for Critical Limb Ischemia
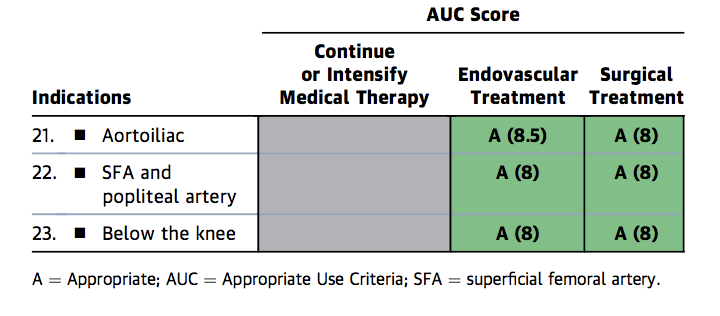
Figure 1b

Figure 1c. Appropriate Use Criteria Device Selection for FP disease
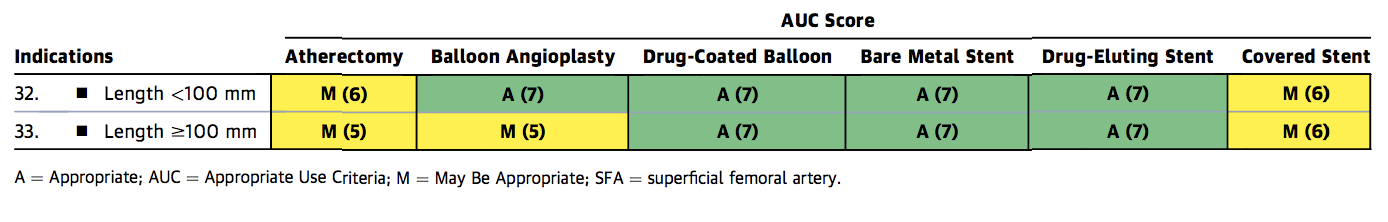
Figure 1c

FP = Femoropopliteal, A = Angemessen, AUC = Geeignete Verwendungskriterien, M = Kann angemessen sein, R = Selten angemessen, SFA = Oberflächliche Oberschenkelarterie.
FP = Femoropopliteal, A = Angemessen, AUC = Geeignete Verwendungskriterien, M = Kann angemessen sein, R = Selten angemessen, SFA = Oberflächliche Oberschenkelarterie.
Die Society for Cardiovascular Angiography and Guidelines kategorisiert Bare-Metal-Stents als IIA und DES als IA-Empfehlung für FP-Erkrankungen.11 Die Society of Vascular surgery guidelines12,13 on Critical Limb ischemia (CLI) empfiehlt die Verwendung von Stents unterhalb des Knies (BTK).Die erste große Studie, in der vaskuläres Stenting mit PTA allein verglichen wurde, wurde 2006 von Schillinger et al. durchgeführt. 3 In der „as treated“ -Analyse war die 12-monatige primäre Durchgängigkeit mit Bare-Metal-Stents deutlich höher (63% vs. 37% p = 0,001). Es folgte die RESILIENT randomisierte Kontrollstudie, in der Bare-Metal-Stents mit dem Lifestent® to PTA verglichen wurden. Die Studie zeigte erneut eine verbesserte primäre Durchgängigkeit nach 3 Jahren (75,5% vs. 41,1% p< 0,001).4
Das nachfolgende SUPERB-Register bewertete den Supera-gewebten Nitinol-Stent und zeigte eine primäre Durchgängigkeit von 86,3% und keine Stentfrakturen.14 Längerfristige Follow-up-Daten zeigten ein 36-monatiges revaskularisationsfreies Überleben der Zielläsion von 82%.1 Nach der Veröffentlichung des Supera-Stents führten mehrere Unternehmen Nitinol-Bare-Metal-Stents ein, die ebenfalls eine niedrige Stentbruchrate und eine gute primäre Durchgängigkeit aufwiesen. Zum Beispiel zeigte der Complete® self expanding Stent (Medtronic, Minneapolis, MN) eine 1-jährige primäre Durchgängigkeit von fast 75% und keine Stentfrakturen in den femoropoplitealen Segmenten (Hinweis: distale popliteale Läsionen wurden ausgeschlossen).15
Drug Eluting Stents
Die Drug Eluting-Technologie war ein wichtiger Fortschritt in der endovaskulären Behandlung von peripheren arteriellen Erkrankungen. Der Zilver® Paclitaxel-eluierende Stent (Cook Medical, Bloomington, IN) wurde bei Bedarf im Vergleich zu optimalem PTA- und Bare-Metal-Stenting untersucht. Die Studie zeigte, dass das Zilver® DES eine überlegene 5-Jahres-Primärdurchgängigkeit aufwies (66,4% vs. 43,4% p <0,001). Auf diese Studie folgte die IMPERIAL-Studie, in der das Eluvia ™ DES (Boston Scientific, Marlborough, MA) im Vergleich zu Zilver® untersucht wurde.16 Eluvia™ erfüllte die vorgegebenen Nichtunterlegenheitskriterien nach 1 Jahr mit 88,5% gegenüber 79,5%, p für Nichtunterlegenheit < 0,01. Eluvia ™ hatte auch eine numerisch geringere Inzidenz schwerwiegender unerwünschter Ereignisse von 4,9% gegenüber 9,0%, p = 0,098.17
NEUARTIGE GERÄTE
Eine breite Palette von Geräten befindet sich in der Entwicklung und einige befinden sich in frühen Phasenversuchen, um den verbleibenden Bedarf in diesem Bereich zu decken. Im Folgenden beschreiben wir einige wichtige Beispiele für neue oder sich entwickelnde Technologien.
Bioabsorbierbare Gefäßgerüste
In den Koronararterien wurden zunächst auflösende bioabsorbierbare Gefäßgerüste (BVS) eingeführt. Die anfängliche Aufregung um diese Geräte wurde mit der Veröffentlichung der randomisierten ABSORB-Studien gemildert, in denen das ABSORB BVS (Abbott Vascular, Chicago, IL) mit Standard-Koronar-DES verglichen wurde (Abbildung 2a).18-20
Abbildung 2a. ABSORBIERBARER bioabsorbierbarer Stent (mit freundlicher Genehmigung von Abbott Vascular)

Abbildung 2a

Eine Metaanalyse von ABSORB mit 3.389 Patienten zeigte eine gerätebedingte Thrombose von 2,3% für BVS gegenüber 0% für DES nach 3 Jahren [HR 3,79 95% CI 1,72-8,36, p = 0,002).21
Trotz der Bedenken im Zusammenhang mit der ersten Generation von BVS in den Herzkranzgefäßen scheint BVS in der Peripherie mit der jüngsten Präsentation der einarmigen ABSORB BTK-Pilotstudie an Dynamik zu gewinnen 5-Jahres-Ergebnisse. Die Studie wurde auf der Tagung Vascular InterVentional Advance (VIVA) 2019 vorgestellt22 und berichtete über die Ergebnisse von 55 mit BVS behandelten Gliedmaßen, die eine vollständige Wundheilungsrate von 90% zeigten. Es gab eine Amputationsrate von 0% und eine 5-jährige primäre Durchgängigkeit des Gefäßes, die sich 75% näherte. Es wird erwartet, dass zwei bevorstehende Studien das Feld weiter erweitern: die LIFE-BTK randomisierte Studie, die das Esprit BVS (Abbott Vascular) gegen PTA allein und die Credence BTK-1-Studie, die eine einarmige Pilotstudie des Credence BTK-Geräts ist (Meril, Gujarat, Indien).
Vascular Tack System
Das Tack endovascular System (InTack Vascular, Wayne, PA) sind kleine Nitinolimplantate mit einer Länge von 6 mm, mit denen Dissektionslappen wieder angebracht werden, um eine Ausbreitung und einen Lumenverlust zu verhindern (Abbildung 2b).
Abbildung 2b. Tack Endovaskuläres System (courtesy Tack Vascular)
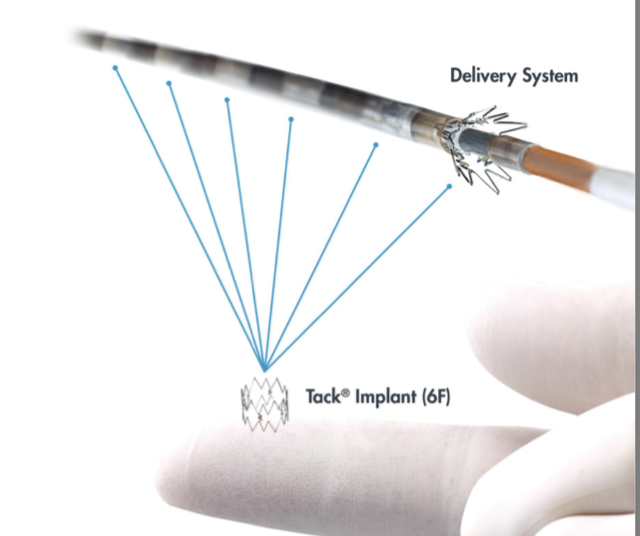
Abbildung 2b

Diese Geräte wurden in die kürzlich veröffentlichte einarmige TOBA II-Studie, die 213 Patienten untersuchte, die nach PTA eine Behandlung mit Tacks erhielten. Die Studie zeigte eine primäre Durchgängigkeitsrate von 79,3% für 1 Jahr, wobei 92,1% der Läsionen eine vollständige Auflösung der Gefäßdissektion aufwiesen.23 Die einarmige multizentrische TOBA III-Studie untersuchte die Reißnägel bei langen Läsionen in Kombination mit einer endgültigen Behandlung mit arzneimittelbeschichteten Ballons, über die kürzlich auf der Transcatheter Cardiovascular Therapeutics Conference (TCT) im Jahr 2019 berichtet wurde. Die Studie zeigte eine primäre Durchgängigkeit von 95% nach 12 Monaten. Darüber hinaus wurde die TOBA II BTK-Studie, die das Gerät in den Tibiagefäßen untersuchte, auf der Vascular InterVentional Advances (VIVA) 2019 vorgestellt. Die Präsentation berichtete über eine 6-Monats-Wundheilungsrate von 73,8% und eine Durchgängigkeit der Zielläsion von 87,3%.
BioMimics 3D Swirling Flow Stent
Der 3D Swirling Flow Stent (Veryan Medical) ist ein spiralförmiger Stent, der auf der Hypothese basiert, dass eine geringe Wandscherspannung, die durch standardmäßige gerade Stents erzeugt wird, das Risiko einer vaskulären Restenose erhöhen kann. Tiermodelle, die den Wirbelfluss-Stent auswerten, haben eine signifikante Verringerung der neointimalen Dicke gezeigt (p <0,001). Die MIMICS 2-Studie, in der das Gerät untersucht wird, steht kurz vor dem Abschluss und sollte in naher Zukunft vorgestellt werden. Die vorläufigen Ergebnisse (wobei 10% der Patienten noch eine endgültige Nachsorge benötigen) zeigten eine 2-Jahres-Freiheit von 84% der Revaskularisation von Zielläsionen.24
ChampioNIR®
Der ChampioNIR® Stent (Medinol Vascular, Tel Aviv, Israel, Abbildung 2c) ist ein hybrider selbstexpandierender Stent, der aus einem radialen Nitinolrahmen mit einem longitudinalen Polymerfasernetz besteht, um „unendliche“ Flexibilität und verbesserte Ermüdungsfestigkeit zu ermöglichen. Das Gerät nimmt derzeit an seiner ersten Studie am Menschen mit erwarteter 3-Jahres-Nachbeobachtung teil.
2c. ChampioNIR® (mit freundlicher Genehmigung von Medinol Vascular)

Abbildung 2c

FAZIT
Gefäßstents und -gerüste spielen eine wesentliche Rolle im endovaskulären Behandlungsalgorithmus der peripheren arteriellen Verschlusskrankheit. Neuartige Geräte sowohl in langlebigen als auch in bioabsorbierbaren Technologien haben sich als vielversprechend erwiesen, und viele werden aktiv in klinischen Studien untersucht. Während bioabsorbierbare Technologien in den Herzkranzgefäßen schlechtere klinische Ergebnisse erzielt haben, werden Geräteiterationen und Versuche im peripheren Gefäßsystem die Möglichkeit für weiteres technologisches Wachstum bieten.
- Garcia LA, Rosenfield KR, Metzger CD, et al. HERVORRAGENDE endgültige 3-Jahres-Ergebnisse mit Interwoven Nitinol Biomimetic supera Stent. Katheter Cardiovasc Interv 2017;89:1259-67.
- AbuRahma AF. Wann werden endovaskuläre und offene Bypass-Behandlungen bei femoropoplitealen Verschlusserkrankungen bevorzugt? Ann Vasc Dis 2018;11:25-40.
- Schillinger M, Sabeti S, Loewe C, et al. Ballonangioplastie versus Implantation von Nitinol-Stents in die A. femoralis superficialis. N Engl J Med 2006;354:1879-88.
- Laird JR, Katzen BT, Scheinert D, et al. Nitinol-Stentimplantation vs. Ballonangioplastie bei Läsionen in den oberflächlichen femoralen und proximalen Poplitealarterien von Patienten mit Claudicatio: Drei-Jahres-Follow-up aus der RESILIENT randomisierten Studie. J Endovasc Ther 2012;19:1-9.
- Katsanos K, Spiliopoulos S, Kitrou P, Krokidis M, Karnabatidis D. Sterberisiko nach Anwendung von mit Paclitaxel beschichteten Ballons und Stents in der Femoropoplitealarterie des Beins: eine systematische Überprüfung und Metaanalyse randomisierter kontrollierter Studien. J Am Herz Assoc 2018;7:e011245.
- Schneider PA, Laird JR., Doros G, et al. Mortalität, die nicht mit der Paclitaxel-Exposition korreliert: Eine unabhängige Metaanalyse auf Patientenebene eines arzneimittelbeschichteten Ballons. J Am Coll Cardiol 2019;73:2550-63.
- Ouriel K, Adelman MA, Rosenfield K, et al. Sicherheit der Paclitaxel-beschichteten Ballonangioplastie bei femoropoplitealer peripherer arterieller Verschlusskrankheit. JACC Cardiovasc Interv 2019;12:2515-24.
- Gray WA, Jaff HERR, Parikh SA, et al. Mortalitätsbewertung von Paclitaxel-beschichteten Ballons: Metaanalyse auf Patientenebene des klinischen ILLUMENATE-Programms nach 3 Jahren. Auflage 2019;140:1145-55.
- Schreiber EA, Kundi H, Weinberg I, et al. Assoziation des Überlebens mit der Revaskularisation der Femoropoplitealarterie mit arzneimittelbeschichteten Geräten. JAMA Cardiol 2019;4:332-40.
- Bailey SR, Beckman JA, Dao TD, et al. ACC / AHA / SCAI / SIR / SVM 2018 Geeignete Verwendungskriterien für periphere Arterieninterventionen. J Am Coll Cardiol 2019;73:214-37.
- Feldman DN, Armstrong EJ, Aronow HD, et al. SCAI-Konsensrichtlinien für die Geräteauswahl bei femoral-poplitealen arteriellen Interventionen. Katheter Cardiovasc Interv 2018;92:124-40.Lawrence PF, Gloviczki P. Globale vaskuläre Richtlinien für Patienten mit chronischer extremitätenbedrohlicher Ischämie. J Vasc Surg 2019;69:1S-2S.
- Conte MS, Bradbury AW, Kolh P, et al. Globale vaskuläre Richtlinien zur Behandlung chronischer extremitätenbedrohlicher Ischämie. Eur J Vasc Endovasc Surg 2019;58:S1-109.
- Garcia L, Jaff MR, Metzger C, et al. Draht-verwobener Nitinol-Stent Ergebnis in den oberflächlichen femoralen und proximalen Poplitealarterien: Zwölfmonatige Ergebnisse der SUPERB-Studie. Circ Cardiovasc Interv 2015;8: e000937.
- Laird JR, Jain A, Zeller T, et al. Implantation von Nitinol-Stents in die A. femoralis superficialis und A. poplitea proximal: Zwölfmonatige Ergebnisse der multizentrischen Studie Complete SE. J Endovasc Ther 2014;21:202-12.
- Dake MD, Ansel GM, Lottes AE. Zilver PTX RCT-Mortalitätsanalyse: Kein Unterschied in der Langzeitmortalitätsrate für den Zilver PTX-arzneimitteleluierenden Stent im Vergleich zu PTA / BMS. CVIR Endovasc 2019;2:25.
- Gray WA, Keirse K, Soga Y, et al. Ein polymerbeschichteter, Paclitaxel-eluierender Stent (Eluvia) versus ein polymerfreier, Paclitaxel-beschichteter Stent (Zilver PTX) für die endovaskuläre femoropopliteale Intervention (IMPERIAL): eine randomisierte, Nicht-Minderwertigkeitsstudie. Lanzette 2018; 392: 1541-51.
- Stein GW, Ellis SG, Gori T, et al. Verblindete Ergebnisse und Angina-Beurteilung koronarer bioresorbierbarer Gerüste: 30-Tage- und 1-Jahres-Ergebnisse der randomisierten ABSORB IV-Studie. Lanzette 2018;392: 1530-40.
- Ali ZA, Serruys PW, Kimura T, et al. 2-Jahres-Ergebnisse mit dem Absorb bioresorbierbaren Gerüst zur Behandlung der koronaren Herzkrankheit: eine systematische Überprüfung und Metaanalyse von sieben randomisierten Studien mit einer individuellen Patientendaten-Teilstudie. Lanzette 2017;390: 760-72.
- Stein GW, Ellis S, Simonton C, et al. Ergebnisse des Absorb bioresorbierbaren Gefäßgerüsts in sehr kleinen und nicht sehr kleinen Koronararterien: die ABSORB III randomisierte Studie. J Am Coll Cardiol 2016;67:35.
- Ali ZA, Gao R, Kimura T, et al. Drei-Jahres-Ergebnisse mit dem Absorb bioresorbable Scaffold: individuelle Patientendaten-Metaanalyse aus den ABSORB randomisierten Studien. Auflage 2018;137:474-79.
- Fünfjahresergebnisse der ABSORB BTK-Studie vorgestellt (Endovascular Today Website). 2019. Verfügbar unter: https://evtoday.com/news/five-year-results-from-absorb-btk-trial-presented . Zugriff 02/25/20.
- Gray WA, Cardenas JA, Brodmann M, et al. Behandlung der Post-Angioplastie-Dissektion in den femoropoplitealen Arterien mit dem Tack endovaskulären System: 12-Monats-Ergebnisse aus der TOBA II-Studie. JACC Cardiovasc Interv 2019;12:2375-84.
- Swirling Flow®: nature’s ideal alternative to drug elution (Webseite von Endovascular Today). 2019. Available at: https://evtoday.com/articles/2019-sept/swirling-flow-natures-ideal-alternative-to-drug-elution. Accessed 02/25/20.
Clinical Topics: Invasive Cardiovascular Angiography and Intervention, Stable Ischemic Heart Disease, Vascular Medicine, Atherosclerotic Disease (CAD/PAD), Interventions and Vascular Medicine, Chronic Angina
Keywords: Gefäßerkrankungen, Aneurysma, Periphere arterielle Verschlusskrankheit, Claudicatio Intermittens, Arzneimittel-eluierende Stents, Verengung, Pathologisch, Paclitaxel, Oberschenkelarterie, United States Food and Drug Administration, Koronargefäße, Medicare, Inzidenz, Pilotprojekte, Koronare Restenose, Follow-Up-Studien
< Zurück zu den Auflistungen