7.1: Organische Moleküle
Organische Moleküle und Isomerie
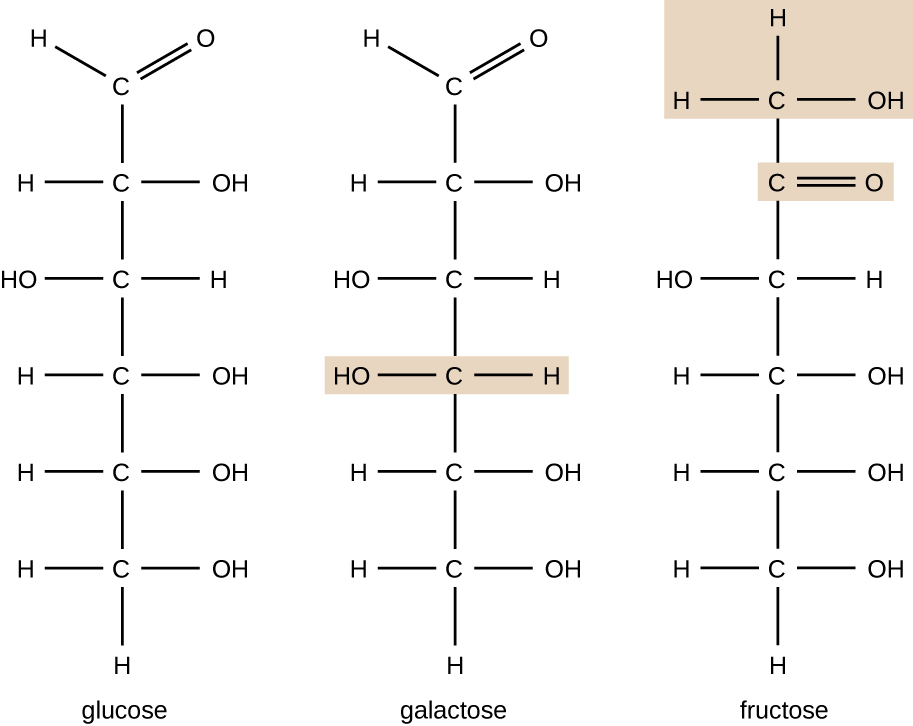
Organische Moleküle in Organismen sind im Allgemeinen größer und komplexer als anorganische Moleküle. Ihre Kohlenstoffgerüste werden durch kovalente Bindungen zusammengehalten. Sie bilden die Zellen eines Organismus und führen die chemischen Reaktionen durch, die das Leben erleichtern. Alle diese Moleküle, die Biomoleküle genannt werden, weil sie Teil lebender Materie sind, enthalten Kohlenstoff, der der Baustein des Lebens ist. Kohlenstoff ist ein sehr einzigartiges Element, da es vier Valenzelektronen in seinen äußeren Orbitalen hat und vier einzelne kovalente Bindungen mit bis zu vier anderen Atomen gleichzeitig bilden kann (siehe Anhang A). Diese Atome sind normalerweise Sauerstoff, Wasserstoff, Stickstoff, Schwefel, Phosphor und Kohlenstoff selbst; Die einfachste organische Verbindung ist Methan, in dem Kohlenstoff nur an Wasserstoff bindet (Abbildung \(\pageIndex{2} \)).Aufgrund der einzigartigen Kombination von Größe und Bindungseigenschaften von Kohlenstoff können sich Kohlenstoffatome in großer Zahl miteinander verbinden und so eine Kette oder ein Kohlenstoffgerüst bilden. Das Kohlenstoffgerüst organischer Moleküle kann gerade, verzweigt oder ringförmig (cyclisch) sein. Organische Moleküle sind auf Ketten von Kohlenstoffatomen unterschiedlicher Länge aufgebaut; Die meisten sind typischerweise sehr lang, was eine große Anzahl und Vielfalt von Verbindungen ermöglicht. Kein anderes Element hat die Fähigkeit, so viele verschiedene Moleküle in so vielen verschiedenen Größen und Formen zu bilden.Moleküle mit der gleichen atomaren Zusammensetzung, aber unterschiedlicher struktureller Anordnung der Atome werden Isomere genannt. Das Konzept der Isomerie ist in der Chemie sehr wichtig, da die Struktur eines Moleküls immer direkt mit seiner Funktion zusammenhängt. Geringfügige Änderungen in der strukturellen Anordnung von Atomen in einem Molekül können zu sehr unterschiedlichen Eigenschaften führen. Chemiker stellen Moleküle durch ihre Strukturformel dar, die eine grafische Darstellung der Molekülstruktur darstellt und zeigt, wie die Atome angeordnet sind. Verbindungen, die identische Molekülformeln haben, sich aber in der Bindungsreihenfolge der Atome unterscheiden, werden als Strukturisomere bezeichnet. Die Monosaccharide Glucose, Galactose und Fructose haben alle die gleiche Summenformel, C6H12O6, aber wir können aus Abbildung \ (\pageIndex {3}\) sehen, dass die Atome unterschiedlich miteinander verbunden sind.
Isomere, die sich in der räumlichen Anordnung der Atome unterscheiden, werden Stereoisomere genannt; Ein einzigartiger Typ sind Enantiomere. Die Eigenschaften von Enantiomeren wurden ursprünglich 1848 von Louis Pasteur entdeckt, als er mit einem Mikroskop kristallisierte Fermentationsprodukte von Wein analysierte. Enantiomere sind Moleküle, die die Eigenschaft der Chiralität haben, in denen ihre Strukturen nicht unüberwindbare Spiegelbilder voneinander sind. Chiralität ist ein wichtiges Merkmal in vielen biologisch wichtigen Molekülen, wie die Beispiele für strukturelle Unterschiede in den enantiomeren Formen des Monosaccharids Glucose oder der Aminosäure Alanin zeigen (Abbildung \(\pageIndex{4}\)).Viele Organismen sind nur in der Lage, eine enantiomere Form bestimmter Arten von Molekülen als Nährstoffe und als Bausteine zu verwenden, um Strukturen innerhalb einer Zelle zu bilden. Einige enantiomere Formen von Aminosäuren haben deutlich unterschiedliche Geschmäcker und Gerüche, wenn sie als Nahrung verzehrt werden. Zum Beispiel schmeckt L-Aspartam, allgemein Aspartam genannt, süß, während D-Aspartam geschmacklos ist. Arzneimittel-Enantiomere können sehr unterschiedliche pharmakologische Wirkungen haben. Zum Beispiel existiert die Verbindung Methorphan als zwei Enantiomere, von denen eines als Antitussivum wirkt (Dextromethorphan, ein Hustenmittel), während das andere als Analgetikum wirkt (Levomethorphan, ein Medikament, dessen Wirkung Codein ähnelt).
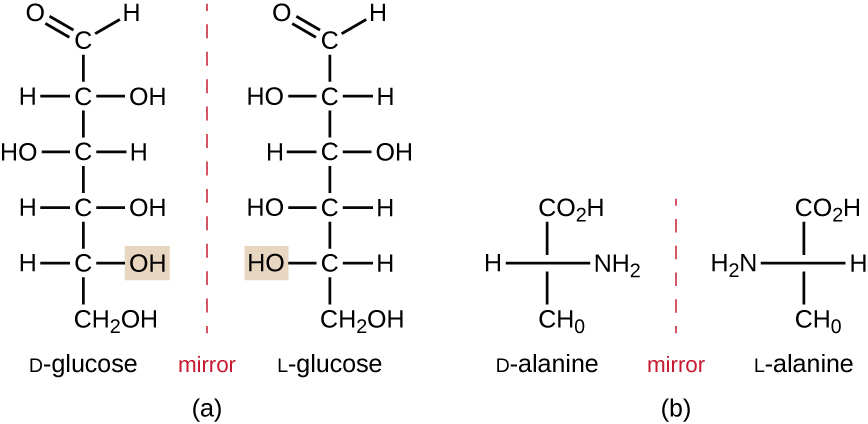
Enantiomere werden auch als optische Isomere bezeichnet, da sie die Ebene des polarisierten Lichts drehen können. Einige der Kristalle, die Pasteur bei der Weingärung beobachtete, drehten das Licht im Uhrzeigersinn, während andere das Licht gegen den Uhrzeigersinn drehten. Heute bezeichnen wir Enantiomere, die polarisiertes Licht im Uhrzeigersinn drehen (+) als d−Formen und das Spiegelbild desselben Moleküls, das polarisiertes Licht gegen den Uhrzeigersinn dreht (-) als l-Form. Die d- und l-Beschriftungen leiten sich von den lateinischen Wörtern dexter (rechts) bzw. laevus (links) ab. Diese beiden unterschiedlichen optischen Isomere haben oft sehr unterschiedliche biologische Eigenschaften und Aktivitäten. Bestimmte Arten von Schimmelpilzen, Hefen und Bakterien wie Rhizopus, Yarrowia und Lactobacillus spp. kann jeweils nur eine Art von optischem Isomer metabolisieren; Das entgegengesetzte Isomer ist nicht als Nährstoffquelle geeignet. Ein weiterer wichtiger Grund, sich der optischen Isomere bewusst zu sein, ist die therapeutische Verwendung dieser Arten von Chemikalien zur medikamentösen Behandlung, da einige Mikroorganismen nur von einem bestimmten optischen Isomer beeinflusst werden können.
Exercise \(\pageIndex{3}\)
Wir sagen, dass das Leben auf Kohlenstoff basiert. Was macht Kohlenstoff so geeignet, Teil aller Makromoleküle lebender Organismen zu sein?